(Triméthylsilyl)méthyllithium
| (Triméthylsilyl)méthyllithium | |
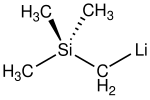
| |
| Structure du (triméthylsilyl)méthyllithium | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.157.622 |
| No CE | 629-440-7 |
| PubChem | 3482579 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | (CH3)3SiCH2Li |
| Masse molaire[1] | 94,157 ± 0,006 g/mol C 51,02 %, H 11,78 %, Li 7,37 %, Si 29,83 %, |
| Précautions | |
| SGH[2] | |
| H225, H314, H318, P210, P233, P240, P241, P242, P243, P260, P264, P280, P321, P363, P301+P330+P331, P303+P361+P353, P304+P340, P370+P378, P405, P403+P235 et P501 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le (triméthylsilyl)méthyllithium est un organolithien organosilicié de formule chimique (CH3)3SiCH2Li, souvent abrégée LiCH2tms, où « tms » représente le groupe triméthylsilyle –Si(CH3)3. Il cristallise sous la forme d'un hexamère prismatique hexagonal [LiCH2tms]6, semblable à certains polymorphes du méthyllithium CH3Li[3]. On en a caractérisé de nombreux adduits, dont les complexes d'éther diéthylique à géométrie cubane Li4(μ3-CH2tms)4(Et2O)2[4] et Li2(μ-CH2tms)2(tmeda)2[5].
Production[modifier | modifier le code]
Le (triméthylsilyl)méthyllithium est distribué commercialement en solution dans le tétrahydrofurane (THF). Il est généralement produit en traitant du chlorométhyltriméthylsilane (CH3)3SiCH2Cl avec le n-butyllithium CH3CH2CH2CH2Li[6] :
- (CH3)3SiCH2Cl + CH3CH2CH2CH2Li ⟶ (CH3)3SiCH2Li + CH3CH2CH2CH2Cl.
Le réactif de Grignard chlorure de (triméthylsilyl)méthylmagnésium (CH3)3SiCH2MgCl est souvent utilisé de manière équivalente au (triméthylsilyl)méthyllithium ; il est préparé par réaction de Grignard sur le chlorure de (triméthylsilyl)méthyle[7],[8].
Application à la formation d'alcènes[modifier | modifier le code]
Un exemple de réaction de Peterson fait intervenir du (triméthylsilyl)méthyllithium (R4 = Me, R3 = H) avec des aldéhydes (R2 = alkyle et R1 = H) et des cétones (R2 = R1 = alkyle) pour donner des alcènes terminaux >C=CH2 :
-
Oléfination de Peterson.
Dérivés métalliques[modifier | modifier le code]
Le (triméthylsilyl)méthyllithium est largement utilisé en chimie des organométalliques avec des métaux de transition pour fixer des ligands (triméthylsilyl)méthyle (CH3)3SiCH2–. Ces complexes sont généralement obtenus par métathèse à l'aide de chlorures de métaux de transition (en). Ces composés sont souvent très solubles dans les solvants organiques. Ils sont rendus stables par l'encombrement stérique des ligands (triméthylsilyl)méthyle ; ils résistent à l'élimination de β-hydrure, et de ce point de vue le ligand (triméthylsilyl)méthyle est semblable au ligand néopentyle (CH3)3C–.
-
Structure du complexe organométallique de scandium avec deux ligands (triméthylsilyl)méthyle (C5H5)Sc(CH2tms)2(thf), où « tms » = (CH3)3Si– et « thf » = tétrahydrofurane[9]. __ Si __ Sc __ O.
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « (Trimethylsilyl)methyllithium GHS Classification », sur pubchem.ncbi.nlm.nih.gov, NCBI, NLM, NIH (consulté le ).
- (en) Berhan Tecle, A. F. M. Maqsudur Rahman et John P. Oliver, « X-ray crystal structure of trimethylsilylmethyllithium », Journal of Organometallic Chemistry, vol. 317, no 3, , p. 267-275 (DOI 10.1016/0022-328X(86)80537-X, lire en ligne).
- (en) Tanja Tatic, Kathrin Meindl, Julian Henn, Sushil Kumar Pandey et Dietmar Stalke, « The first asymmetric organolithium tetramers with simple ether donor bases », Chemical Communications, vol. 46, no 25, , p. 4562-4564 (PMID 20502820, DOI 10.1039/c002504f, lire en ligne)
- (en) Tanja Tatic, Holger Ott et Dietmar Stalke, « Deaggregation of Trimethylsilylmethyllithium », European Journal of Inorganic Chemistry, vol. 2008, no 24, , p. 3765-3768 (DOI 10.1002/ejic.200800610, lire en ligne)
- (en) David J. Ager, David J. Ager et Jacob Werth, « Trimethylsilylmethyllithium », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rt321.pub3, lire en ligne)
- (en) David J. Brennan, James M. Graaskamp, Beverly S. Dunn, Harry R. Allcock et Michael Sennett, « Organosilicon Derivatives of Cyclic and High Polymeric Phosphazenes », Inorganic Syntheses, vol. 25, (DOI 10.1002/9780470132562.ch15, lire en ligne)
- (en) Takayuki Shioiri, Toyohiko Aoyama et Shigehiro Mori, « Trimethylsilyldiazomethane », Organic Syntheses, vol. 68, , p. 1 (DOI 10.15227/orgsyn.068.0001, lire en ligne)
- (en) Xiaofang Li, Masayoshi Nishiura, Lihong Hu, Kyouichi Mori et Zhaomin Hou, « Alternating and Random Copolymerization of Isoprene and Ethylene Catalyzed by Cationic Half-Sandwich Scandium Alkyls », Journal of the American Chemical Society, vol. 131, no 38, , p. 13870-13882 (PMID 19728718, DOI 10.1021/ja9056213, lire en ligne)




![Structure du complexe organométallique de scandium avec deux ligands (triméthylsilyl)méthyle (C5H5)Sc(CH2tms)2(thf), où « tms » = (CH3)3Si– et « thf » = tétrahydrofurane[9]. __ Si __ Sc __ O.](http://upload.wikimedia.org/wikipedia/commons/thumb/1/19/LURKIT.png/511px-LURKIT.png)