Acide croconique
| Acide croconique | |
| |
| Identification | |
|---|---|
| Nom UICPA | 4,5-dihydroxycyclopent-4-ène-1,2,3-trione |
| Synonymes |
4,5-dihydroxy-4-cyclopentène-1,2,3-trione |
| No CAS | |
| No ECHA | 100.201.686 |
| PubChem | 546874 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H2O5 [Isomères] |
| Masse molaire[1] | 142,066 4 ± 0,005 6 g/mol C 42,27 %, H 1,42 %, O 56,31 %, |
| Propriétés physiques | |
| T° fusion | >300 °C[2] |
| Cristallographie | |
| Système cristallin | orthorhombique[3] |
| Classe cristalline ou groupe d’espace | Pca21[3] |
| Paramètres de maille | a = 8,710 8 Å b = 5,168 3 Å |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
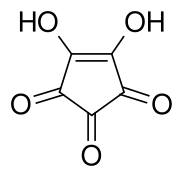
L'acide croconique ou la 1,2-dihydroxycyclopentènetrione est le composé organique de formule brute C5H2O5 ou (C=O)3(COH)2. Il est composé d'un squelette cyclopentène avec deux groupes hydroxyles adjacents à la double liaison et trois groupes cétones sur les atomes de carbone restants. Il est sensible à la lumière[4], soluble dans l'eau et l'éthanol[5] et forme des cristaux jaunes qui se décomposent à 212 °C[6].
Ce composé est un acide car il perd ses protons (cation H+) de ses hydroxyles à un pH bas (pKa1 = 0.80 ± 0.08 et pKa2 = 2.24 ± 0.01 à 25 °C)[7],[8]. Les anions résultants, hydrogénocroconate[4], C5HO5− et croconate, C5O52− sont aussi assez stables. En particulier, le dianion croconate est aromatique et symétrique, la double liaison et les charges négatives sont délocalisées sur le cinq sous-unités CO. Les croconates de lithium, de sodium et de potassium cristallisent de l'eau en dihydrates[3] mais le sel orange du potassium peut être déshydraté pour former un monohydrate[4],[7].
Les croconates d'ammonium, de rubidium et de césium cristallisent sous forme anhydre[3]. Les sels de baryum, de plomb, d'argent, etc. sont aussi connus[4].
L'acide croconique peut aussi former des esters comme le croconate de diméthyle.
Histoire[modifier | modifier le code]
L'acide croconique et le croconate de potassium dihydrate ont été découverts par Leopold Gmelin en 1825 qui nomma ces composés d'après le grec τό χρόχον, « safran » ou « jaune d'œuf »[3]. La structure du croconate d'ammonium a été déterminée par Baenziger et al. en 1964 ; la structure de K2C5O5 . 2H2O a été déterminée par J. D. Dunitz en 2001[9].
Structure[modifier | modifier le code]
À l'état solide, l'acide croconique a une structure constituée de bandes plissées, chaque bande étant un anneau planaire de quatre molécules de C5O5H2 liées par des liaisons hydrogène[3].
Dans l'état solide des sels de métal alcalin, les anions croconates et les cations alcalins forment des colonnes parallèles[3]. Dans le sel mixte K3(C5HO5)(C5O5)·2H2O qui contient formellement des dianions croconates et des anions hydrogénocroconates, l'hydrogène est partagé également entre deux unités croconates adjacentes[3].
Notes[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Croconic acid » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Croconic acid sur Sigma-Aldrich.com
- Dario Braga, Lucia Maini, Fabrizia Grepioni, Croconic Acid and Alkali Metal Croconate Salts: Some New Insights into an Old Story, Chemistry - A European Journal, 2002, vol. 8(8), pp. 1804–1812. DOI 10.1002/1521-3765(20020415)8:8<1804::AID-CHEM1804>3.0.CO;2-C
- Kiyoyuki Yamada, Nobuhisa Mizuno and Yoshimasa Hirata, Structure of Croconic Acid, Bulletin of the Chemical Society of Japan, 1958, vol. 31(5), pp. 543-549. DOI 10.1246/bcsj.31.543.
- William Allen Miller, Elements of chemistry: theoretical and practical, 1868, 4e édition, 884 pages, Longmans.
- Edward Turner, Elements of chemistry.
- Lowell M. Schwmtr Robert I. Gelb, and Janet 0. Yardley, Aqueous Dissociation of Croconic Acid, J. Phys. Chem., 1975, vol. 79(21), pp. 2246–2251. DOI 10.1021/j100588a009.
- Robert I. Gelb, Lowell M. Schwartz, Daniel A. Laufer, Janet O. Yardley, The structure of aqueous croconic acid, J. Phys. Chem., 1977, vol. 81(13), pp. 1268–1274. DOI 10.1021/j100528a010.
- J. D. Dunitz, P. Seiler, W. Czchtizky, Angew. Chem., 2001, vol. 113, p. 1829; Angew. Chem. Int. Ed. vol 40, p. 1779.
