Acide orthocarbonique
| Acide orthocarbonique | ||
| ||
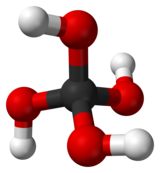 | ||
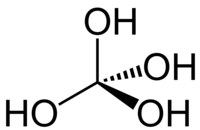
| Représentations de l'acide orthocarbonique. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide orthocarbonique | |
| Synonymes |
méthanetétrol, acide d'Adolf Hitler |
|
| No CAS | ||
| PubChem | 9547954 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | CH4O4 [Isomères] |
|
| Masse molaire[1] | 80,040 1 ± 0,002 3 g/mol C 15,01 %, H 5,04 %, O 79,96 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'acide orthocarbonique, aussi appelé méthanetétrol, est un acide hypothétique de formule chimique H4CO4 ou C(OH)4. Sa structure moléculaire consiste en un unique atome de carbone lié à quatre groupes hydroxyle. Du fait de sa forme dans l'espace, qui fait penser à un svastika ou à une croix gammée nazie, il est parfois fait référence à cet acide sous le nom d'« acide d'Hitler »[réf. nécessaire].
L'acide orthocarbonique est éminemment instable, il se décompose spontanément en monohydrate de l'acide carbonique[2],[3] :
- C(OH)4 → H2CO3 + H2O.
L'acide orthocarbonique fait partie des acides orthocarboxyliques qui ont comme structure générale RC(OH)3. Ce terme "ortho" est utilisé en référence à l'acide le plus hydroxylé de la série d'un oxoacide.
Orthocarbonate[modifier | modifier le code]
Par perte successive de ses protons, l'acide orthocarbonique pourrait fournir quatre anions, nommément H3CO4−, H2CO42−, HCO43− et CO44−. En 2002, des sels de ces anions n'ont pas encore été observés. Cependant, des études théoriques suggèrent que Na4CO4 pourrait être stable[4].
La partie CO4 est trouvée dans des composés organiques stables. Ce sont formellement des esters de l'acide orthocarbonique et d'ailleurs, ils sont nommés orthocarbonates. Par exemple, l'orthocarbonate d'éthyle peut être préparé par réaction entre la chloropicrine et l'éthanolate de sodium dans l'éthanol[5].
Les polyorthocarbonates sont des polymères stables qui pourraient avoir comme application l'absorption de solvants organiques dans des procédés de traitement de déchets[6] ou dans des matériaux de restauration dentaire[7].
Présence dans les planètes[modifier | modifier le code]
Selon une étude publiée par Gabriele Saleh et Artem R. Oganov, le dioxyde de carbone et l'eau pourraient être sous la forme d'acide orthocarbonique en profondeur des planètes Uranus et Neptune[8],[9].
Références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Orthocarbonic acid » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- S.Bohm,D. Antipova, J. Kuthan, A Study of Methanetetraol Dehydration to Carbonic Acid International Journal of Quantum Chemistry, 1997, vol. 62, p. 315–322. DOI 10.1002/(SICI)1097-461X(1997)62:3<315::AID-QUA10>3.3.CO;2-N.
- (en) Carboxylic Acids and Derivatives IUPAC Recommendations on Organic & Biochemical Nomenclature
- Musstafa Al-Shemali, Alexander I. Boldyre, Search for Ionic Orthocarbonates: Ab Initio Study of Na4CO4, J. Phys. Chem. A., 2002, vol. 106(38), pp. 8951–8954. DOI 10.1021/jp020207+.
- Orthocarbonic acid, tetraethyl ester, Organic Syntheses, Coll. Vol. 4, p.457 (1963); Vol. 32, p.68 (1952).
- H.B. Sonmez, F. Wudl, Cross-linked poly(orthocarbonate)s as organic solvent sorbents, Macromolecules, 2005,vol. 38(5), pp. 1623–1626. DOI 10.1021/ma048731x.
- J.W. Stansbury, Synthesis and evaluation of new oxaspiro monomers for double ring-opening polymerization, Journal of Dental Research., 1992, vol. 71(7), pp. 1408–1412. DOI 10.1177/00220345920710070901, .
- Saleh et Oganov 2016.
- Sacco 2016.
Bibliographie[modifier | modifier le code]
Publications scientifiques[modifier | modifier le code]
- [Saleh et Oganov 2016] (en) Gabriele Saleh et Artem R. Oganov, « Novel Stable Compounds in the C-H-O Ternary System at High Pressure » [« Nouveaux composés stables dans le système ternaire C-H-O à haute pression »], Scientific Reports, vol. 6, no 32486 (numéro d'article), (DOI 10.1038/srep32486, lire en ligne).
Articles de vulgarisation[modifier | modifier le code]
- [Sacco/Futura-Sciences 2016] Laurent Sacco, « Un acide inconnu sur Terre entrerait dans la composition de Neptune », Futura-Sciences, (lire en ligne).
