Bis(stilbènedithiolate) de nickel
| Bis(stilbènedithiolate) de nickel | |
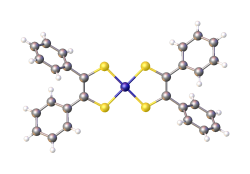
| |
| Structure du bis(stilbènedithiolate) de nickel[1] | |
| Identification | |
|---|---|
| Synonymes |
Bis(dithiobenzil)nickel(II) |
| No CAS | |
| No ECHA | 100.044.853 |
| No CE | 249-353-4 |
| PubChem | 5374634 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | Ni(S2C2Ph2)2 |
| Masse molaire[2] | 543,412 ± 0,044 g/mol C 61,89 %, H 3,71 %, Ni 10,8 %, S 23,6 %, |
| Propriétés physiques | |
| T° ébullition | 364,5 °C[3] à 1 atm |
| Point d’éclair | 174,2 °C[3] |
| Précautions | |
| SGH[3] | |
| H317, H334, H350, H372, P201, P202, P260, P264, P270, P272, P280, P284, P308+P313, P405 et P501 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le bis(stilbènedithiolate) de nickel est un complexe de coordination de formule chimique Ni(S2C2Ph2)2, où PH représente un phényle –C6H5. Il se présente sous la forme d'un solide noir qui donne des solutions vertes dans le toluène. Ce complexe est le prototype d'une grande famille de complexes de bis(dithiolène (en)) de formule générale Ni(S2C2R2)2, où R représente un atome d'hydrogène H ou un groupe alkyle ou aryle. Ces complexes ont été étudiés comme teintures. Ils présentent en outre un intérêt académique comme exemples de ligands non innocents[4]. La longueur des liaisons C–S et C–C vaut respectivement 171 pm et 139 pm, ce qui est intermédiaire entre liaison simple et double[1].
Ce complexe a été préparé au départ en traitant du sulfure de nickel avec du diphénylacétylène C6H5–C≡C–C6H5[5]. Les synthèses à haut rendement font intervenir le traitement de sels de nickel avec de la benzoïne sulfurée. Le complexe réagit avec les ligands pour former des complexes de monodithiolène de type Ni(S2C2Ph2)L2[6].
Notes et références[modifier | modifier le code]
- (en) Qingqing Miao, Junxiong Gao, Zeqing Wang, Hang Yu, Yi Luo et Tingli Ma, « Syntheses and characterization of several nickel bis(dithiolene) complexes with strong and broad Near-IR absorption », Inorganica Chimica Acta, vol. 376, no 1, , p. 619-627 (DOI 10.1016/j.ica.2011.07.046, lire en ligne)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Bis(dithiobenzil)nickel(II), consultée le 18 septembre 2021.
- (en) K. D. Karlin, E. I. Stiefel, Progress in Inorganic Chemistry, Dithiolene Chemistry: Synthesis, Properties, and Applications, Wiley-Interscience, New York, 2003. (ISBN 0-471-37829-1)
- (en) G. N. Schrauzer et V. Mayweg, « Reaction of Diphenylacetylene with Nickel Sulfides », Journal of the American Chemical Society, vol. 84, no 16, , p. 3221 (DOI 10.1021/ja00875a061, lire en ligne)
- (en) Antony Obanda, Kristina Martinez, Russell H. Schmehl, Joel T. Mague, Igor V. Rubtsov, Samantha N. MacMillan, Kyle M. Lancaster, Stephen Sproules et James P. Donahue, « Expanding the Scope of Ligand Substitution from [M(S2C2Ph2] (M = Ni2+, Pd2+, Pt2+) To Afford New Heteroleptic Dithiolene Complexes », Inorganic Chemistry, vol. 56, no 17, , p. 10257-10267 (PMID 28820242, DOI 10.1021/acs.inorgchem.7b00971, lire en ligne)


