Chlorure de molybdène(V)
| Chlorure de molybdène(V) | |
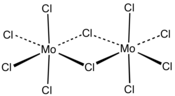
| |
| Structure du chlorure de molybdène(V). | |
| Identification | |
|---|---|
| Nom UICPA | pentachloromolybdène |
| No CAS | |
| No ECHA | 100.030.510 |
| No CE | 233-575-3 |
| No RTECS | QA4690000 |
| PubChem | 61497 |
| ChEBI | 30635 |
| SMILES | |
| InChI | |
| Apparence | poudre bleu-noir[1] |
| Propriétés chimiques | |
| Formule | MoCl5 |
| Masse molaire[2] | 273,23 ± 0,03 g/mol Cl 64,88 %, Mo 35,12 %, |
| Propriétés physiques | |
| T° fusion | 194 °C[1] |
| T° ébullition | 268 °C[1] |
| Solubilité | réagit violemment au contact de l'eau |
| Masse volumique | 2,928 g/cm3[1] à 20 °C |
| Précautions | |
| SGH[1] | |
| H314, P280, P310 et P305+P351+P338 |
|
| NFPA 704[3] | |
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le chlorure de molybdène(V), ou pentachlorure de molybdène, est un composé chimique de formule (MoCl5)2. Il se présente sous la forme d'un solide bleu-noir ininflammable très hygroscopique paramagnétique à l'odeur piquante et qui réagit violemment au contact de l'eau. Sa couleur peut virer au vert foncé s'il développe des oxychlorures. Sa molécule à l'état solide est un dimère, qui se dissocie en monomères à l'état gazeux, où il prend une teinte rouge[4].
Structure et propriétés[modifier | modifier le code]
Le pentachlorure de molybdène cristallise dans une forme α du système monoclinique selon le groupe d'espace C/2m (no 12) avec comme paramètres cristallins a = 1 731 pm, b = 1 781 pm, c = 607,9 pm et β = 95,7°[5], soit une structure cristalline distincte de celle du NbCl5. On en connaît également trois autres polymorphes : la forme β a une structure cristalline triclinique avec le groupe d'espace P1 (no 2), la forme γ a une structure cristalline orthorhombique avec le groupe d'espace Pnma (no 62) et la forme δ a une structure cristalline monoclinique avec le groupe d'espace P21/c (no 14)[6].
Il est soluble dans l'eau et l'éthanol après solvolyse en donnant une solution vert foncé, et sans se décomposer dans des solvants organiques tels que l'éther diéthylique, le chloroforme, le tétrachlorométhane (donnant une solution rouge foncé), ou encore le disulfure de carbone.
Production et réactions[modifier | modifier le code]
Le pentachlorure de molybdène peut être obtenu en faisant réagir du molybdène dans du chlore Cl2 en l'absence d'oxygène O2[5]. Avant la réaction, la poudre métallique doit être chauffée à des températures élevées dans un courant d'hydrogène H2 ou d'azote N2 dépourvu d'oxygène pour éliminer tout oxyde de surface. Des précautions doivent alors être prises pour s'assurer que l'air et l'humidité sont complètement éliminés du milieu réactionnel avant la réaction avec le chlore[7] :
On peut également l'obtenir en faisant réagir du trioxyde de molybdène MoO3 avec du tétrachlorométhane CCl4 sous pression[4].
Le pentachlorure de molybdène est réduit par l'acétonitrile CH3CN pour donner un complexe orange MoCl4(CH3CN)2 qui réagit avec le tétrahydrofurane (THF) pour donner le MoCl4(THF)2, précurseur d'autres complexes de molybdène[8].
Le bromure de molybdène(IV) (en) MoBr4 est obtenu par traitement de pentachlorure de molybdène par le bromure d'hydrogène HBr :
Cette réaction fait intervenir du bromure de molybdène(V) MoBr5 instable, qui libère du brome Br2 à température ambiante[9].
Le pentachlorure de molybdène est un bon acide de Lewis envers les ligands non oxydables. Il forme un adduit avec le chlore pour donner [MoCl6]−. En synthèse organique, il peut être utilisé pour réaliser des réactions de chloration, de désoxygénation ou de couplage oxydant[10].
Applications[modifier | modifier le code]
Le pentachlorure de molybdène peut être utilisé pour déposer du molybdène[11].
Notes et références[modifier | modifier le code]
- Entrée « Molybdenum(V) chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 avril 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Molybdenum(V) chloride, 99.6% (metals basis) », sur Alfa Aesar (consulté le ).
- (en) Mary Eagleson, Concise Encyclopedia Chemistry, Walter de Gruyter, 1994, p. 662. (ISBN 3-11-011451-8)
- (de) Georg Brauer, Handbuch der Präparativen Anorganischen Chemie, 3e édition, vol. 3, Ferdinand Enke, Stuttgart, 1981, p. 1534. (ISBN 3-432-87823-0)
- (en) J. Beck and F. Wolf, « Three New Polymorphic Forms of Molybdenum Pentachloride », Acta Crystallographica Section B, vol. 53, , p. 895-903 (DOI 10.1107/S0108768197008331, lire en ligne)
- (en) A. P. Hagen, Inorganic Reactions and Methods, The Formation of Bonds to Halogens, John Wiley & Sons, 2009, p. 171. (ISBN 0-470-14539-0)
- (en) Jonathan R. Dilworth, Raymond L. Richards, Grace J.-J. Chen et John W. Mcdonald, « The Synthesis of Molybdenum and Tungsten Dinitrogen Complexes », Inorganic Syntheses: Reagents for Transition Metal Complex and Organometallic Syntheses, vol. 28, (DOI 10.1002/9780470132593.ch7, lire en ligne)
- (en) Fausto Calderazzo, Cäcilie Maichle-Mössmer, Guido Pampaloni et Joachim Strähle, « Low-temperature syntheses of vanadium(III) and molybdenum(IV) bromides by halide exchange », Journal of the Chemical Society, Dalton Transactions, no 5, , p. 655-658 (DOI 10.1039/DT9930000655, lire en ligne)
- (en) T. Kauffmann, S. Torii et T. Inokuchi, « Molybdenum(V) Chloride », Encyclopedia of Reagents for Organic Synthesis, J. Wiley & Sons, 2004. (ISBN 978-0471936237)
- (en) Dale L. Perry, Handbook of Inorganic Compounds, Second Edition, Taylor & Francis, 2011, p. 281. (ISBN 1-4398-1462-7)



