Extraction à deux phases aqueuses
L'extraction à deux phases aqueuses est une extraction liquide-liquide qui a lieu grâce à un système biphasique "phase aqueuse / phase aqueuse"[1]. Ce système biphasique est appelé système aqueux à deux phases (SADP). Ce système est utilisé principalement dans le domaine de la biochimie afin de séparer des composés relativement fragiles tels que des protéines, des virus, des cellules, des acides nucléiques et d’autres biomolécules[2].
Description[modifier | modifier le code]
Un système aqueux à deux phases consiste en un mélange de deux liquides aqueux concentrés, au-dessus d’un certain point critique, soit de polymères, de sels, de molécules d’alcool de faible masse molaire, de tensioactifs et/ou de liquides ioniques différents. Ce mélange formera deux phases bien distinctes. L'extraction à deux phases aqueuses est très similaire au principe d’une extraction liquide-liquide à l’aide d’une phase aqueuse et d’une phase organique. Ce dernier type d’extraction (phase organique / phase aqueuse) est cependant relativement très peu efficace dans le cadre de la séparation et de la récupération de macromolécules biologiques en raison de la faible solubilité des protéines dans la phase aqueuse la majorité du temps[3].
L’utilisation d’une extraction à deux phases aqueuses peut présenter plusieurs avantages. Premièrement, ce type de séparation peut être utilisé autant à petite échelle, qu’à grande échelle, voire à échelle industrielle, puisque le SADP est capable de retenir des masses assez importantes de produits à séparer comparativement à d’autres techniques de séparation. Également, cette technique peut, tout dépendant des molécules à séparer, réduire le nombre de séparations nécessaires à l’obtention du produit pur, réduisant du même coup les coûts reliés à la séparation. De plus, les composés chimiques qui sont utilisés sont majoritairement peu toxiques, à l’instar d’autres méthodes de séparation, ce qui est excellent au point de vue environnemental et humain[3]. Il semble également être possible de recycler la majorité des phases, ainsi que des polymères, ce qui a un impact économique et environnemental majeur[4].
Histoire[modifier | modifier le code]
L'extraction à deux phases aqueuses est une technique de séparation qui est maintenant fréquemment utilisée dans les laboratoires du monde entier. Le principe de séparation à l’aide de deux phases aqueuses a été documenté pour la première fois en 1896. Il s’agit d’un microbiologiste hollandais, Martinus Willem Beijerinck, qui a décrit pour la première fois cette technique de séparation. Celui-ci a mélangé en solution aqueuse un polymère, du agar, ainsi que de la gélatine pour finalement remarquer que la solution se séparait en deux phases non miscibles. Il s’est avéré que la couche du bas contenait la majorité du agar et que la couche du haut contenait la majorité de la gélatine. Il s’agit de la première fois que le phénomène de séparation de deux phases immiscibles à base d’eau qui caractérise le système aqueux à deux phases a été décrit dans la littérature[5].
Sans toutefois connaitre le potentiel qu’offrait le SADP, deux chercheurs ont décrit en 1946, la miscibilité de paires de polymères dans un système aqueux. Cela dit, il était commun de voir deux polymères faire deux phases distinctes dans l’eau. Par après, ce n’est qu’autour de 1950 qu’Albertsson a démontré le potentiel qu’avait le SADP pour séparer des biomolécules. Celui-travaillait sur la séparation des pyrénoïdes d’une sorte d’algues unicellulaires, la Chlorella pyrenoidosa. Plusieurs techniques ont été utilisées, mais sans succès telle que la chromatographie. Elle s’est avérée inefficace dû à l’incapacité d’éluer les molécules de la colonne à cause de plusieurs facteurs telle que la grosseur de celle-ci. Par hasard, Albertsson a ajouté du polyéthylène glycol et du phosphate de potassium à sa solution contenant son échantillon. Bien qu’il n’y a pas eu la séparation des pyrénoïdes, il a vu la couleur verte caractéristique des chloroplastes se retrouver dans la phase de polyéthylène glycol et l’hydroxyapatite se retrouver dans la phase du bas. Une première séparation de composants biologique avait été effectuée à l’aide d’une extraction à deux phases aqueuses. Il avait donc trouvé par hasard une méthode très prometteuse pour effectuer une séparation de composants biologiques ou encore, de macromolécule[5]. Cette technique après cette expérience, a fait preuve d’un bon potentiel dans la séparation des protéines, des composants cellulaires ou encore, des enzymes ce qui a suscité l’intérêt des scientifiques.
Principes[modifier | modifier le code]
Les mécanismes de la séparation derrière l'extraction à deux phases aqueuses restent encore plutôt méconnus par la communauté scientifique, c’est pourquoi il n’y a pas encore d’autre moyen que d’y aller de manière empirique afin de collecter des données, c’est-à-dire par essais et erreurs. Cependant, certains fondements et faits sont connus par rapport à la séparation des molécules dans ce type de système. Bien évidemment la nature physico-chimique des molécules en jeu, telle que leur taille, leurs charges et leur polarité, a un impact sur la séparation des molécules, mais la composition du système global a aussi un impact sur la séparation. Par exemple, la composition du système (les deux phases) possède plusieurs variables affectant la séparation des molécules, telles que l’effet stérique, les forces de van der Waals, les ponts hydrogène, les interactions hydrophobes, le pH. Cela indique qu’il est possible d’obtenir une séparation beaucoup plus spécifique d’une molécule voulue. Il est possible d’effectuer un criblage à haut débit ou bien un plan d’expérience afin de déterminer la meilleure approche possible pour séparer le composé voulu, bien que ces méthodes ne soient pas toujours efficaces à 100%[4].
Lorsque deux liquides aqueux concentrés de deux polymères différents sont mélangés entre eux, il est possible qu’il n’y ait qu’une seule phase homogène, ou bien deux phases distinctes (formant un SADP). Si l’énergie du système est assez grande afin de surmonter la différence entre l’entropie et l’enthalpie d’hydratation, le système sera homogène (dans le cas contraire, le système possèdera deux phases). Comme le graphique ci-dessous le montre, le système ayant des concentrations suffisantes (qui se retrouve au-dessus de la courbe, appelée « courbe binodale ») possèdera deux phases[3].
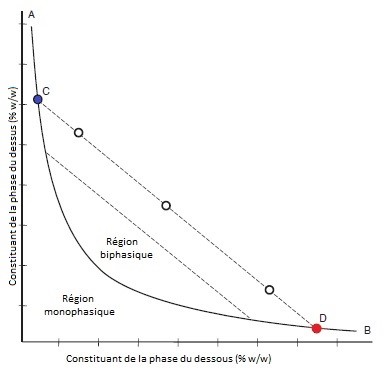
La droite coupant la courbe binodale sert d’indication des concentrations de chaque phase ainsi que du système total. Le point le plus à gauche (C) représente la concentration de chacun des constituants de la phase du dessus (ex : dextran et polyéthylène glycol), le point le plus à droite (D) représente les concentrations des deux constituants dans la phase du dessous. Un point blanc représente la concentration totale du système des deux constituants. Cela indique donc qu’il peut y avoir plus qu’une combinaison de concentration totale afin de donner la même concentration de constituant dans chaque phase[6].
Catégorie de séparations[modifier | modifier le code]
Séparation dépendante de la taille[modifier | modifier le code]
Chaque molécule possède un volume et une géométrie définis, ils sont donc sujets aux effets stériques dans le SADP. Nous pouvons considérer que chaque phase possède un certain volume disponible pour les solutés, plus connu sous le nom de l’« effet du volume libre ». Les systèmes polymères-polymère et polymère-sel sont reconnus pour utiliser ce principe. Puisque les polymères et les ions en solution occupent déjà un espace assez volumineux, le volume libre de chaque phase se voit être largement réduit. C’est ainsi que, pour cette raison, les solutés très volumineux, tels que les cellules vivantes, les organelles et les molécules avec une masse molaire très élevée, se voient redirigés vers l’interface du système, contrairement aux molécules peu volumineuses qui ne se voient pas être beaucoup affectées par ce paramètre[3].
Séparation électro-chimiquement dépendante[modifier | modifier le code]
Plusieurs constituants des phases aqueuses du SADP possèdent des charges ioniques ou bien des dipôles, tels les sels, les liquides ioniques et certains polymères comme le dextran et le polyéthylène glycol. Les interactions électrochimiques peuvent avoir un rôle capital dans la séparation des particules. Puisque les charges opposées s’attirent entre elles, il est donc possible d’y avoir une certaine sélectivité à ce niveau. Le pH possède donc une grande importance, car il peut aider à promouvoir à une séparation plus sélective en formant des ions par exemple[7].
Séparation dépendante de l’hydrophobie[modifier | modifier le code]
Les interactions hydrophobiques jouent un rôle majeur dans la séparation des molécules. Certaines molécules étant d’habitude hydrophiles peuvent être considérées comme étant hydrophobes dans un système donné en raison de leur caractère amphiphile (une partie de la molécule est hydrophile et une autre est hydrophobe). La phase de dessus est généralement plus hydrophobe que l’autre, c’est donc là que les molécules moins hydrophiles risquent de s’y retrouver. Il est également possible, en allongeant les molécules, d’augmenter l’hydrophobicité d’un polymère, tel le polyéthylène glycol, ce qui a pour effet d’encore mieux séparer les solutés. De manière empirique, les protéines, ayant des groupements assez hydrophobes, ont tendance à aller dans la phase des polymères du dessus, au lieu de celle ionique en dessous. De plus, dans un système polymère-sel ou bien polymère-liquide ionique, l’effet du relargage peut avoir une incidence importante dans la séparation.
Puisque les sels demandent beaucoup d’eau afin d’être dissous, ils peuvent « relarguer » des solutés déjà dans la phase plus hydrophile, vers celle l’étant moins[7].
Séparation par bioaffinité rehaussée[modifier | modifier le code]
Il est possible de cibler très précisément un produit et le répartir de manière très inégale dans l’une ou l’autre des phases. La première technique est l’addition d’un ligand libre. Le principe consiste à introduire un ligand ayant une très forte affinité pour le produit ciblé, tout en répartissant le ligand de manière inégale dans les phases. C’est alors que le produit désiré sera fortement attiré dans la phase où le ligand se trouve.
La deuxième méthode est très similaire à la première, soit la technique du ligand couplé. Le principe reste le même que précédemment, cependant le ligand est lié de manière covalente à une particule dans une phase, comme un polymère par exemple. La molécule ciblée ira donc dans la phase possédant le ligand couplé[7].
Applications[modifier | modifier le code]
L'extraction à deux phases aqueuses est une méthode d’extraction très efficace pour les molécules possédant une taille élevée ou une instabilité dans des solvants autres que l’eau. De plus, elle est avantageuse, car l’extraction peut se faire en continu et les composants utilisés sont peu toxiques. Ils ont une bonne biocompatibilité avec les molécules et il s’agit d’une méthode non destructive[8].
Cette méthode peut aussi être couplée à des systèmes de détection. Aussi, il est possible de faire plusieurs extractions de suite avec des SADP distincts. Cela peut permettre par ailleurs d’intégrer une extraction supplémentaire pour amener l’analyte dans une phase différente de celle qui aurait lieu si une seule extraction avait été faite. Entre les extractions, les paramètres comme la concentration des polymères peuvent varier permettant une variété de propriétés distinctes entre les systèmes[9].
Plusieurs applications possibles de cette méthode sont envisagées comme isoler des composés ayant un potentiel médicinal auparavant difficile à séparer de façon efficace. Des recherches ont travaillé à isoler par exemple des anticorps, des protéines issues du sang, des virus ou encore, des acides nucléiques[8]. Aussi, plusieurs recherches se concentrent sur l’extraction d’enzyme puisque ces molécules sont très polyvalents et peuvent avoir des applications dans plusieurs industries. Par exemple, les enzymes ont du potentiel dans le domaine de l’alimentation, le papier, la médecine ou encore, les détergents.
Aussi, la séparation des virus par extraction à deux phases aqueuses est essentielle pour la fabrication de vaccin et dans la création de médicament. L'extraction à deux phases aqueuses peut aussi être utilisée dans la séparation d’organites ou encore de cellules complètes. Une séparation complète des cellules de fraise cultivée avec un système polyéthylène glycol/Dextran soit deux polymères.
Montage (Préparation)[modifier | modifier le code]
Pour faire une extraction à deux phases aqueuses, il faut commencer par faire un choix des deux ligands à mettre en solution. Il existe quatre types de système ou paire de ligands soit le système polymère-polymère, le système polyélectrolyte-polymère, le système électrolyte-électrolyte et le système polymère-molécule à faible poids moléculaire. Ce choix est souvent basé sur les propriétés de l’échantillon à séparer puisque ceux-ci influencent la séparation et son efficacité.
Pour la séparation de biomolécules telles que des protéines ou plus précisément des enzymes, il est de mise de faire un système avec une concentration en eau élevée. Plus la concentration en eau du SADP est élevée, plus les protéines qui s’y retrouveront seront stables.
Les systèmes utilisés le plus fréquemment dans l’industrie ou en laboratoire sont les systèmes PEG/Dextran dû à leur disponibilité, faible toxicité et leurs propriétés. Les concentrations des composants d’un SADP vont tourner autour de 10 %. Par contre, cela peut varier grandement, car la variation de concentration va faire varier les propriétés du système au même type que la température.
L'extraction à deux phases aqueuses peut être soit en continu sous en discontinu. Celle en continu nécessite plus de matériel, mais elle est bien adaptée pour les situations où il y a une production continue du composé à séparer comme lors d’une fermentation. Aussi, elle permet de faire l’extraction d’une plus grande quantité de composés en moins de temps que l'extraction à deux phases aqueuses conventionnelle[10].
Notes et références[modifier | modifier le code]
- Gérard Cote, Extraction liquide-liquide Présentation générale, Techniques de l’ingénieur, 1998
- R. Hatti-Kaul, Aqueous two phase systems: A General Overview, Molecular Biotechnology 3 (19), 2001 : 269-277
- J. Benavides, M. Rito-Palomares, Aqueous Two-Phase Systems, Comprehensive Biotechnology 2 (2), 2011 : 697-713
- A. M. Azevedo, P. A. J. Rosa, F. Ferreira, M. R. Aires-Barros, Chromatography-free recovery of biopharmaceuticals through aqueous two-phase processing, Trends in Biotechnology 4 (27), 2009 : 240-247.
- H. Walter, D. E. Brooks, D. Fisher, Partitioning in aqueous two-phase system : Theory, methods, uses and application to biotechnology, San Diego, États-Unis, Academy Press, 1985, 704 p.
- H. Walter, G. Johansson, Methods in Enzymology, vol. 228, Aqueous Two-Phase Systems, San Diego, Academic Press, 1994, 725 pages
- J. Benavides, M. Rito-Palomares, Aqueous Two-Phase Systems, Comprehensive Biotechnology 2 (2), 2011 : 697-713
- J. A. Asenjo, B. A. Andrews, Aqueous two-phase systems for protein separation: A perspective, Journal of chromatography A 1218(49), 2011 : 8826-8835
- J. Eggersgluess, T. Wellsandt, J. Strube, Integration of Aqueous Two-Phase Extraction into Downstream Processing, Chemical Engineering and technology 37(10), 2014 : 1686- 1696
- P. G. Mazzola et al., Liquid–liquid extraction of biomolecules: an overview and update of the main techniques, Journal of chemical technology and biotechnology (83)1, 2008 : 143-157
