En thermodynamique , la méthode de Roozeboom permet de déterminer graphiquement les grandeurs molaires partielles d'un mélange binaire. Elle porte le nom de son inventeur, le chimiste néerlandais Hendrik Willem Bakhuis Roozeboom .
La méthode peut être étendue à des mélanges de plus de deux espèces chimiques .
On considère, à pression
P
{\displaystyle P}
température
T
{\displaystyle T}
quantité de matière
n
{\displaystyle n}
espèces chimiques (corps), notées
1
{\displaystyle 1}
2
{\displaystyle 2}
phase . Les quantités
n
1
{\displaystyle n_{1}}
n
2
{\displaystyle n_{2}}
n
=
n
1
+
n
2
{\displaystyle n=n_{1}+n_{2}}
Par définition, les fractions molaires
x
1
{\displaystyle x_{1}}
x
2
{\displaystyle x_{2}}
x
1
=
n
1
n
{\displaystyle x_{1}={n_{1} \over n}}
x
2
=
n
2
n
{\displaystyle x_{2}={n_{2} \over n}}
et vérifient :
x
1
+
x
2
=
1
{\displaystyle x_{1}+x_{2}=1}
Soit
Y
{\displaystyle Y}
extensive du mélange (volume
V
{\displaystyle V}
énergie interne
U
{\displaystyle U}
enthalpie libre
G
{\displaystyle G}
entropie
S
{\displaystyle S}
etc. ). La grandeur molaire
Y
¯
{\displaystyle {\bar {Y}}}
[ 1]
Grandeur molaire :
Y
¯
=
Y
n
{\displaystyle {\bar {Y}}={Y \over n}}
Les grandeurs molaires partielles
Y
¯
1
{\displaystyle {\bar {Y}}_{1}}
Y
¯
2
{\displaystyle {\bar {Y}}_{2}}
dérivées partielles [ 1] , [ 2]
Grandeurs molaires partielles
Y
¯
1
=
(
∂
Y
∂
n
1
)
P
,
T
,
n
2
{\displaystyle {\bar {Y}}_{1}=\left({\partial Y \over \partial n_{1}}\right)_{P,T,n_{2}}}
Y
¯
2
=
(
∂
Y
∂
n
2
)
P
,
T
,
n
1
{\displaystyle {\bar {Y}}_{2}=\left({\partial Y \over \partial n_{2}}\right)_{P,T,n_{1}}}
À pression et température constantes, la grandeur extensive
Y
{\displaystyle Y}
n
1
{\displaystyle n_{1}}
n
2
{\displaystyle n_{2}}
intensives
Y
¯
{\displaystyle {\bar {Y}}}
Y
¯
1
{\displaystyle {\bar {Y}}_{1}}
Y
¯
2
{\displaystyle {\bar {Y}}_{2}}
x
1
{\displaystyle x_{1}}
x
2
{\displaystyle x_{2}}
Lorsque le corps
1
{\displaystyle 1}
est pur,
x
1
=
1
{\displaystyle x_{1}=1}
pour le corps
1
{\displaystyle 1}
:
Y
¯
=
Y
¯
1
=
Y
¯
1
∗
{\displaystyle {\bar {Y}}={\bar {Y}}_{1}={\bar {Y}}_{1}^{*}}
corps
1
{\displaystyle 1}
pur ;
pour le corps
2
{\displaystyle 2}
:
Y
¯
2
=
Y
¯
2
,
1
∞
{\displaystyle {\bar {Y}}_{2}={\bar {Y}}_{2,1}^{\infty }}
corps
2
{\displaystyle 2}
à dilution infinie dans le corps
1
{\displaystyle 1}
. Lorsque le corps
2
{\displaystyle 2}
est pur,
x
2
=
1
{\displaystyle x_{2}=1}
pour le corps
1
{\displaystyle 1}
:
Y
¯
1
=
Y
¯
1
,
2
∞
{\displaystyle {\bar {Y}}_{1}={\bar {Y}}_{1,2}^{\infty }}
corps
1
{\displaystyle 1}
à dilution infinie dans le corps
2
{\displaystyle 2}
;
pour le corps
2
{\displaystyle 2}
:
Y
¯
=
Y
¯
2
=
Y
¯
2
∗
{\displaystyle {\bar {Y}}={\bar {Y}}_{2}={\bar {Y}}_{2}^{*}}
corps
2
{\displaystyle 2}
pur. Le théorème d'Euler permet d'écrire :
Y
=
n
1
Y
¯
1
+
n
2
Y
¯
2
{\displaystyle Y=n_{1}{\bar {Y}}_{1}+n_{2}{\bar {Y}}_{2}}
d'où[ 1] , [ 2] quantité de matière totale
n
{\displaystyle n}
Y
¯
=
x
1
Y
¯
1
+
x
2
Y
¯
2
{\displaystyle {\bar {Y}}=x_{1}{\bar {Y}}_{1}+x_{2}{\bar {Y}}_{2}}
et finalement :
Y
¯
=
(
1
−
x
2
)
Y
¯
1
+
x
2
Y
¯
2
{\displaystyle {\bar {Y}}=\left(1-x_{2}\right){\bar {Y}}_{1}+x_{2}{\bar {Y}}_{2}}
Les définitions des grandeurs molaires partielles donnent :
Y
¯
1
=
(
∂
Y
∂
n
1
)
P
,
T
,
n
2
=
(
∂
n
Y
¯
∂
n
1
)
P
,
T
,
n
2
=
Y
¯
+
n
(
∂
Y
¯
∂
n
1
)
P
,
T
,
n
2
{\displaystyle {\bar {Y}}_{1}=\left({\partial Y \over \partial n_{1}}\right)_{P,T,n_{2}}=\left({\partial n{\bar {Y}} \over \partial n_{1}}\right)_{P,T,n_{2}}={\bar {Y}}+n\left({\partial {\bar {Y}} \over \partial n_{1}}\right)_{P,T,n_{2}}}
Y
¯
2
=
(
∂
Y
∂
n
2
)
P
,
T
,
n
1
=
(
∂
n
Y
¯
∂
n
2
)
P
,
T
,
n
1
=
Y
¯
+
n
(
∂
Y
¯
∂
n
2
)
P
,
T
,
n
1
{\displaystyle {\bar {Y}}_{2}=\left({\partial Y \over \partial n_{2}}\right)_{P,T,n_{1}}=\left({\partial n{\bar {Y}} \over \partial n_{2}}\right)_{P,T,n_{1}}={\bar {Y}}+n\left({\partial {\bar {Y}} \over \partial n_{2}}\right)_{P,T,n_{1}}}
À pression et température constantes, la grandeur molaire
Y
¯
{\displaystyle {\bar {Y}}}
x
1
{\displaystyle x_{1}}
x
2
{\displaystyle x_{2}}
x
1
+
x
2
=
1
{\displaystyle x_{1}+x_{2}=1}
Y
¯
{\displaystyle {\bar {Y}}}
x
2
{\displaystyle x_{2}}
théorème de dérivation des fonctions composées permet d'écrire :
(
∂
Y
¯
∂
n
1
)
P
,
T
,
n
2
=
(
∂
Y
¯
∂
x
2
)
P
,
T
(
∂
x
2
∂
n
1
)
n
2
=
(
∂
Y
¯
∂
x
2
)
P
,
T
(
−
x
2
n
)
{\displaystyle \left({\partial {\bar {Y}} \over \partial n_{1}}\right)_{P,T,n_{2}}=\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}\left({\partial x_{2} \over \partial n_{1}}\right)_{n_{2}}=\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}\left(-{x_{2} \over n}\right)}
(
∂
Y
¯
∂
n
2
)
P
,
T
,
n
1
=
(
∂
Y
¯
∂
x
2
)
P
,
T
(
∂
x
2
∂
n
2
)
n
1
=
(
∂
Y
¯
∂
x
2
)
P
,
T
(
1
n
−
x
2
n
)
{\displaystyle \left({\partial {\bar {Y}} \over \partial n_{2}}\right)_{P,T,n_{1}}=\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}\left({\partial x_{2} \over \partial n_{2}}\right)_{n_{1}}=\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}\left({1 \over n}-{x_{2} \over n}\right)}
On peut donc réécrire[ 1] , [ 2]
Y
¯
1
=
Y
¯
−
x
2
(
∂
Y
¯
∂
x
2
)
P
,
T
{\displaystyle {\bar {Y}}_{1}={\bar {Y}}-x_{2}\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}}
Y
¯
2
=
Y
¯
+
(
1
−
x
2
)
(
∂
Y
¯
∂
x
2
)
P
,
T
{\displaystyle {\bar {Y}}_{2}={\bar {Y}}+\left(1-x_{2}\right)\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}}
On obtient la relation[ 1]
(
∂
Y
¯
∂
x
2
)
P
,
T
=
Y
¯
2
−
Y
¯
1
{\displaystyle \left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}={\bar {Y}}_{2}-{\bar {Y}}_{1}}
Méthode de Roozeboom. Le diagramme représente, à pression et température constantes, une grandeur molaire en fonction de la composition d'un mélange binaire. En un point quelconque de la courbe, la tangente à la courbe donne les grandeurs molaires partielles par ses interceptions des axes des ordonnées 0 et 1[ 1] , [ 2] La grandeur molaire
Y
¯
{\displaystyle {\bar {Y}}}
x
2
{\displaystyle x_{2}}
abscisse
x
2
∘
{\displaystyle x_{2}^{\circ }}
Y
¯
∘
=
Y
¯
(
x
2
∘
)
{\displaystyle {\bar {Y}}^{\circ }={\bar {Y}}\!\left(x_{2}^{\circ }\right)}
Y
¯
1
∘
=
Y
¯
1
(
x
2
∘
)
{\displaystyle {\bar {Y}}_{1}^{\circ }={\bar {Y}}_{1}\!\left(x_{2}^{\circ }\right)}
Y
¯
2
∘
=
Y
¯
2
(
x
2
∘
)
{\displaystyle {\bar {Y}}_{2}^{\circ }={\bar {Y}}_{2}\!\left(x_{2}^{\circ }\right)}
(
∂
Y
¯
∂
x
2
)
P
,
T
∘
=
(
∂
Y
¯
∂
x
2
)
P
,
T
(
x
2
∘
)
{\displaystyle \left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}^{\circ }=\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}\!\left(x_{2}^{\circ }\right)}
La tangente à la courbe en ce point a pour équation :
y
∘
(
x
2
)
=
(
∂
Y
¯
∂
x
2
)
P
,
T
∘
×
(
x
2
−
x
2
∘
)
+
Y
¯
∘
{\displaystyle y^{\circ }\!\left(x_{2}\right)=\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}^{\circ }\times \left(x_{2}-x_{2}^{\circ }\right)+{\bar {Y}}^{\circ }}
En substituant les relations :
Y
¯
∘
=
(
1
−
x
2
∘
)
Y
¯
1
∘
+
x
2
∘
Y
¯
2
∘
{\displaystyle {\bar {Y}}^{\circ }=\left(1-x_{2}^{\circ }\right)\,{\bar {Y}}_{1}^{\circ }+x_{2}^{\circ }\,{\bar {Y}}_{2}^{\circ }}
(
∂
Y
¯
∂
x
2
)
P
,
T
∘
=
Y
¯
2
∘
−
Y
¯
1
∘
{\displaystyle \left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T}^{\circ }={\bar {Y}}_{2}^{\circ }-{\bar {Y}}_{1}^{\circ }}
on obtient l'équation de la tangente à la courbe de
Y
¯
{\displaystyle {\bar {Y}}}
x
2
∘
{\displaystyle x_{2}^{\circ }}
x
2
{\displaystyle x_{2}}
[ 1]
Tangente en
x
2
∘
{\displaystyle x_{2}^{\circ }}
y
∘
(
x
2
)
=
(
Y
¯
2
∘
−
Y
¯
1
∘
)
×
x
2
+
Y
¯
1
∘
{\displaystyle y^{\circ }\!\left(x_{2}\right)=\left({\bar {Y}}_{2}^{\circ }-{\bar {Y}}_{1}^{\circ }\right)\times x_{2}+{\bar {Y}}_{1}^{\circ }}
En conséquence, les grandeurs molaires partielles peuvent être déterminées graphiquement par les interceptions de la tangente et des axes des corps purs[ 1]
lorsque
x
2
=
0
{\displaystyle x_{2}=0}
y
∘
(
0
)
=
Y
¯
1
∘
{\displaystyle y^{\circ }\!\left(0\right)={\bar {Y}}_{1}^{\circ }}
ordonnées
x
2
=
0
{\displaystyle x_{2}=0}
grandeur molaire partielle
Y
¯
1
{\displaystyle {\bar {Y}}_{1}}
x
2
∘
{\displaystyle x_{2}^{\circ }}
lorsque
x
2
=
1
{\displaystyle x_{2}=1}
y
∘
(
1
)
=
Y
¯
2
∘
{\displaystyle y^{\circ }\!\left(1\right)={\bar {Y}}_{2}^{\circ }}
x
2
=
1
{\displaystyle x_{2}=1}
Y
¯
2
{\displaystyle {\bar {Y}}_{2}}
x
2
∘
{\displaystyle x_{2}^{\circ }}
Dans un mélange idéal , les grandeurs molaires partielles
Y
¯
1
{\displaystyle {\bar {Y}}_{1}}
Y
¯
2
{\displaystyle {\bar {Y}}_{2}}
grandeurs molaires
Y
¯
1
∗
{\displaystyle {\bar {Y}}_{1}^{*}}
Y
¯
2
∗
{\displaystyle {\bar {Y}}_{2}^{*}}
corps
1
{\displaystyle 1}
et
2
{\displaystyle 2}
[ 1]
Y
¯
1
id
=
Y
¯
1
∗
{\displaystyle {\bar {Y}}_{1}^{\text{id}}={\bar {Y}}_{1}^{*}}
Y
¯
2
id
=
Y
¯
2
∗
{\displaystyle {\bar {Y}}_{2}^{\text{id}}={\bar {Y}}_{2}^{*}}
Les grandeurs
Y
¯
1
∗
{\displaystyle {\bar {Y}}_{1}^{*}}
Y
¯
2
∗
{\displaystyle {\bar {Y}}_{2}^{*}}
Y
¯
{\displaystyle {\bar {Y}}}
[ 1]
Y
¯
id
=
x
1
Y
¯
1
id
+
x
2
Y
¯
2
id
{\displaystyle {\bar {Y}}^{\text{id}}=x_{1}{\bar {Y}}_{1}^{\text{id}}+x_{2}{\bar {Y}}_{2}^{\text{id}}}
Par définition, une grandeur de mélange est l'écart entre une grandeur réelle et la grandeur idéale correspondante[ 1]
Y
¯
mix
=
Y
¯
−
Y
¯
id
{\displaystyle {\bar {Y}}^{\text{mix}}={\bar {Y}}-{\bar {Y}}^{\text{id}}}
On définit les grandeurs de mélange molaires partielles :
Y
¯
1
mix
=
(
∂
n
Y
¯
mix
∂
n
1
)
P
,
T
,
n
2
=
Y
¯
1
−
Y
¯
1
id
=
Y
¯
1
−
Y
¯
1
∗
{\displaystyle {\bar {Y}}_{1}^{\text{mix}}=\left({\partial \,n{\bar {Y}}^{\text{mix}} \over \partial n_{1}}\right)_{P,T,n_{2}}={\bar {Y}}_{1}-{\bar {Y}}_{1}^{\text{id}}={\bar {Y}}_{1}-{\bar {Y}}_{1}^{*}}
Y
¯
2
mix
=
(
∂
n
Y
¯
mix
∂
n
2
)
P
,
T
,
n
1
=
Y
¯
2
−
Y
¯
2
id
=
Y
¯
2
−
Y
¯
2
∗
{\displaystyle {\bar {Y}}_{2}^{\text{mix}}=\left({\partial \,n{\bar {Y}}^{\text{mix}} \over \partial n_{2}}\right)_{P,T,n_{1}}={\bar {Y}}_{2}-{\bar {Y}}_{2}^{\text{id}}={\bar {Y}}_{2}-{\bar {Y}}_{2}^{*}}
On a sur les grandeurs de mélange les mêmes relations que celles obtenues plus haut :
Y
¯
mix
=
(
1
−
x
2
)
Y
¯
1
mix
+
x
2
Y
¯
2
mix
{\displaystyle {\bar {Y}}^{\text{mix}}=\left(1-x_{2}\right){\bar {Y}}_{1}^{\text{mix}}+x_{2}{\bar {Y}}_{2}^{\text{mix}}}
(
∂
Y
¯
mix
∂
x
2
)
P
,
T
=
Y
¯
2
mix
−
Y
¯
1
mix
{\displaystyle \left({\partial {\bar {Y}}^{\text{mix}} \over \partial x_{2}}\right)_{P,T}={\bar {Y}}_{2}^{\text{mix}}-{\bar {Y}}_{1}^{\text{mix}}}
Dans un diagramme représentant
Y
¯
mix
{\displaystyle {\bar {Y}}^{\text{mix}}}
x
2
{\displaystyle x_{2}}
tangente en un point d'abscisse
x
2
∘
{\displaystyle x_{2}^{\circ }}
Tangente en
x
2
∘
{\displaystyle x_{2}^{\circ }}
y
∘
(
x
2
)
=
(
Y
¯
2
mix
,
∘
−
Y
¯
1
mix
,
∘
)
×
x
2
+
Y
¯
1
mix
,
∘
{\displaystyle y^{\circ }\!\left(x_{2}\right)=\left({\bar {Y}}_{2}^{{\text{mix}},\circ }-{\bar {Y}}_{1}^{{\text{mix}},\circ }\right)\times x_{2}+{\bar {Y}}_{1}^{{\text{mix}},\circ }}
avec :
Y
¯
1
mix
,
∘
=
Y
¯
1
mix
(
x
2
∘
)
{\displaystyle {\bar {Y}}_{1}^{{\text{mix}},\circ }={\bar {Y}}_{1}^{\text{mix}}\!\left(x_{2}^{\circ }\right)}
Y
¯
2
mix
,
∘
=
Y
¯
2
mix
(
x
2
∘
)
{\displaystyle {\bar {Y}}_{2}^{{\text{mix}},\circ }={\bar {Y}}_{2}^{\text{mix}}\!\left(x_{2}^{\circ }\right)}
En conséquence[ 2] , [ 3]
lorsque
x
2
=
0
{\displaystyle x_{2}=0}
y
∘
(
0
)
=
Y
¯
1
mix
,
∘
{\displaystyle y^{\circ }\!\left(0\right)={\bar {Y}}_{1}^{{\text{mix}},\circ }}
x
2
∘
{\displaystyle x_{2}^{\circ }}
Y
¯
1
∘
=
Y
¯
1
∗
+
Y
¯
1
mix
,
∘
{\displaystyle {\bar {Y}}_{1}^{\circ }={\bar {Y}}_{1}^{*}+{\bar {Y}}_{1}^{{\text{mix}},\circ }}
lorsque
x
2
=
1
{\displaystyle x_{2}=1}
y
∘
(
1
)
=
Y
¯
2
mix
,
∘
{\displaystyle y^{\circ }\!\left(1\right)={\bar {Y}}_{2}^{{\text{mix}},\circ }}
x
2
∘
{\displaystyle x_{2}^{\circ }}
Y
¯
2
∘
=
Y
¯
2
∗
+
Y
¯
2
mix
,
∘
{\displaystyle {\bar {Y}}_{2}^{\circ }={\bar {Y}}_{2}^{*}+{\bar {Y}}_{2}^{{\text{mix}},\circ }}
Cette variante est utilisée lorsque les grandeurs réelles sont peu différentes des grandeurs idéales (lorsque les grandeurs de mélange sont faibles), par exemple sur des volumes. Elle permet une plus grande précision dans le tracé de la tangente et la lecture des résultats. En pratique, la grandeur extensive
Y
{\displaystyle Y}
n
{\displaystyle n}
intensive
Y
¯
{\displaystyle {\bar {Y}}}
Y
¯
=
Y
/
n
{\displaystyle {\bar {Y}}=Y/n}
fraction molaire
x
2
{\displaystyle x_{2}}
Y
¯
1
∗
{\displaystyle {\bar {Y}}_{1}^{*}}
Y
¯
2
∗
{\displaystyle {\bar {Y}}_{2}^{*}}
Y
¯
id
=
(
1
−
x
2
)
Y
¯
1
∗
+
x
2
Y
¯
2
∗
{\displaystyle {\bar {Y}}^{\text{id}}=\left(1-x_{2}\right){\bar {Y}}_{1}^{*}+x_{2}{\bar {Y}}_{2}^{*}}
Y
¯
mix
=
Y
¯
−
Y
¯
id
{\displaystyle {\bar {Y}}^{\text{mix}}={\bar {Y}}-{\bar {Y}}^{\text{id}}}
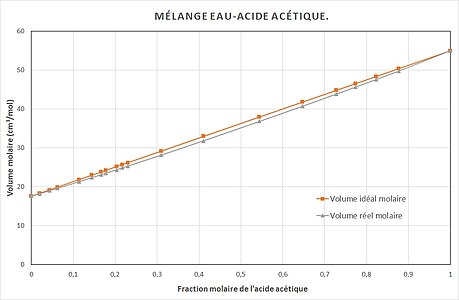
Le volume molaire
V
¯
{\displaystyle {\bar {V}}}
20 °C ) constantes en fonction de la composition en acide acétique[ 4]
eau :
V
¯
eau
∗
{\displaystyle {\bar {V}}_{\text{eau}}^{*}}
cm3 mol−1
acide acétique :
V
¯
aac
∗
{\displaystyle {\bar {V}}_{\text{aac}}^{*}}
cm3 mol−1 Le volume idéal molaire
V
¯
id
{\displaystyle {\bar {V}}^{\text{id}}}
x
aac
{\displaystyle x_{\text{aac}}}
V
¯
id
=
(
1
−
x
aac
)
V
¯
eau
∗
+
x
aac
V
¯
aac
∗
{\displaystyle {\bar {V}}^{\text{id}}=\left(1-x_{\text{aac}}\right){\bar {V}}_{\text{eau}}^{*}+x_{\text{aac}}{\bar {V}}_{\text{aac}}^{*}}
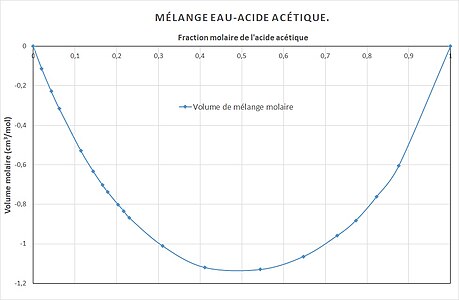
Le volume de mélange molaire est calculé selon :
V
¯
mix
=
V
¯
−
V
¯
id
{\displaystyle {\bar {V}}^{\text{mix}}={\bar {V}}-{\bar {V}}^{\text{id}}}
Les figures suivantes représentent les grandeurs ainsi déterminées en fonction de
x
aac
{\displaystyle x_{\text{aac}}}
Volume molaire
V
¯
{\displaystyle {\bar {V}}}
et volume idéal molaire
V
¯
id
{\displaystyle {\bar {V}}^{\text{id}}}
.
Volume de mélange molaire
V
¯
mix
{\displaystyle {\bar {V}}^{\text{mix}}}
.
Le tableau suivant donne le volume molaire d'un mélange binaire eau-acide acétique à 20 °C .
Volume molaire d'un mélange eau-acide acétique à 20 °C (cm3 mol−1 ).
Fraction molaire
x
aac
{\displaystyle x_{\text{aac}}}
V
¯
{\displaystyle {\bar {V}}}
V
¯
id
{\displaystyle {\bar {V}}^{\text{id}}}
V
¯
mix
{\displaystyle {\bar {V}}^{\text{mix}}}
0 (eau pure)
18,048
18,048
0
0,020
18,720
18,833
-0,113
0,043
19,507
19,735
-0,228
0,062
20,166
20,481
-0,315
0,114
21,992
22,521
-0,529
0,144
23,065
23,699
-0,634
0,166
23,859
24,562
-0,703
0,178
24,296
25,033
-0,737
0,203
25,213
26,014
-0,801
0,217
25,729
26,563
-0,834
0,230
26,205
27,073
-0,868
0,310
29,201
30,212
-1,011
0,411
33,056
34,176
-1,120
0,544
38,265
39,395
-1,130
0,647
42,371
43,436
-1,065
0,728
45,656
46,615
-0,959
0,773
47,499
48,381
-0,882
0,823
49,582
50,343
-0,761
0,876
51,817
52,422
-0,605
1 (acide acétique pur)
57,288
57,288
0
La régression polynomiale de la courbe
V
¯
mix
{\displaystyle {\bar {V}}^{\text{mix}}}
x
acc
{\displaystyle x_{\text{acc}}}
V
¯
mix
(
0
)
=
V
¯
mix
(
1
)
=
0
{\displaystyle {\bar {V}}^{\text{mix}}\!\left(0\right)={\bar {V}}^{\text{mix}}\!\left(1\right)=0}
V
¯
mix
{\displaystyle {\bar {V}}^{\text{mix}}}
x
aac
4
{\displaystyle {x_{\text{aac}}}^{4}}
x
aac
3
{\displaystyle {x_{\text{aac}}}^{3}}
x
aac
2
{\displaystyle {x_{\text{aac}}}^{2}}
x
aac
{\displaystyle x_{\text{aac}}}
(
∂
V
¯
mix
∂
x
aac
)
P
,
T
{\displaystyle \left({\partial {\bar {V}}^{\text{mix}} \over \partial x_{\text{aac}}}\right)_{P,T}}
x
aac
3
{\displaystyle {x_{\text{aac}}}^{3}}
x
aac
2
{\displaystyle {x_{\text{aac}}}^{2}}
x
aac
{\displaystyle x_{\text{aac}}}
Méthode de Roozeboom pour
x
aac
{\displaystyle x_{\text{aac}}}
En
x
aac
∘
{\displaystyle x_{\text{aac}}^{\circ }}
V
¯
mix
{\displaystyle {\bar {V}}^{\text{mix}}}
V
¯
mix
,
∘
{\displaystyle {\bar {V}}^{{\text{mix}},\circ }}
(
∂
V
¯
mix
∂
x
aac
)
P
,
T
∘
{\displaystyle \left({\partial {\bar {V}}^{\text{mix}} \over \partial x_{\text{aac}}}\right)_{P,T}^{\circ }}
v
∘
{\displaystyle v^{\circ }}
x
aac
{\displaystyle x_{\text{aac}}}
En conséquence :
lorsque
x
aac
=
0
{\displaystyle x_{\text{aac}}=0}
v
∘
(
0
)
=
V
¯
eau
mix
,
∘
{\displaystyle v^{\circ }\!\left(0\right)={\bar {V}}_{\text{eau}}^{{\text{mix}},\circ }}
cm3 mol−1 le volume molaire partiel de l'eau pour
x
aac
∘
{\displaystyle x_{\text{aac}}^{\circ }}
V
¯
eau
∘
=
V
¯
eau
∗
+
V
¯
eau
mix
,
∘
{\displaystyle {\bar {V}}_{\text{eau}}^{\circ }={\bar {V}}_{\text{eau}}^{*}+{\bar {V}}_{\text{eau}}^{{\text{mix}},\circ }}
cm3 mol−1 lorsque
x
aac
=
1
{\displaystyle x_{\text{aac}}=1}
v
∘
(
1
)
=
V
¯
aac
mix
,
∘
{\displaystyle v^{\circ }\!\left(1\right)={\bar {V}}_{\text{aac}}^{{\text{mix}},\circ }}
cm3 mol−1 le volume molaire partiel de l'acide acétique pour
x
aac
∘
{\displaystyle x_{\text{aac}}^{\circ }}
V
¯
aac
∘
=
V
¯
aac
∗
+
V
¯
aac
mix
,
∘
{\displaystyle {\bar {V}}_{\text{aac}}^{\circ }={\bar {V}}_{\text{aac}}^{*}+{\bar {V}}_{\text{aac}}^{{\text{mix}},\circ }}
cm3 mol−1 Appliqué à l'eau pure,
x
aac
∘
=
0
{\displaystyle x_{\text{aac}}^{\circ }=0}
v
∘
{\displaystyle v^{\circ }}
x
aac
{\displaystyle x_{\text{aac}}}
pour l'eau pure :
V
¯
eau
∘
=
V
¯
eau
∗
{\displaystyle {\bar {V}}_{\text{eau}}^{\circ }={\bar {V}}_{\text{eau}}^{*}}
cm3 mol−1
pour l'acide acétique infiniment dilué dans l'eau :
V
¯
acc
∘
=
V
¯
acc,eau
∞
{\displaystyle {\bar {V}}_{\text{acc}}^{\circ }={\bar {V}}_{\text{acc,eau}}^{\infty }}
cm3 mol−1 Appliqué à l'acide acétique pur,
x
aac
∘
=
1
{\displaystyle x_{\text{aac}}^{\circ }=1}
v
∘
{\displaystyle v^{\circ }}
x
aac
{\displaystyle x_{\text{aac}}}
pour l'eau infiniment diluée dans l'acide acétique :
V
¯
eau
∘
=
V
¯
eau,acc
∞
{\displaystyle {\bar {V}}_{\text{eau}}^{\circ }={\bar {V}}_{\text{eau,acc}}^{\infty }}
cm3 mol−1
pour l'acide acétique pur :
V
¯
acc
∘
=
V
¯
acc
∗
{\displaystyle {\bar {V}}_{\text{acc}}^{\circ }={\bar {V}}_{\text{acc}}^{*}}
cm3 mol−1 La méthode de Roozeboom peut être étendue à des mélanges de plus de deux espèces chimiques (corps). Dans un mélange ternaire, contenant trois corps notés
1
{\displaystyle 1}
2
{\displaystyle 2}
3
{\displaystyle 3}
grandeur molaire
Y
¯
{\displaystyle {\bar {Y}}}
grandeurs molaires partielles
Y
¯
1
{\displaystyle {\bar {Y}}_{1}}
Y
¯
2
{\displaystyle {\bar {Y}}_{2}}
Y
¯
3
{\displaystyle {\bar {Y}}_{3}}
P
{\displaystyle P}
T
{\displaystyle T}
fractions molaires
x
1
{\displaystyle x_{1}}
x
2
{\displaystyle x_{2}}
x
3
{\displaystyle x_{3}}
x
1
+
x
2
+
x
3
=
1
{\displaystyle x_{1}+x_{2}+x_{3}=1}
En fixant le ratio
K
=
x
1
/
x
3
{\displaystyle K=x_{1}/x_{3}}
x
1
=
K
1
+
K
(
1
−
x
2
)
{\displaystyle x_{1}={K \over 1+K}\left(1-x_{2}\right)}
x
3
=
1
1
+
K
(
1
−
x
2
)
{\displaystyle x_{3}={1 \over 1+K}\left(1-x_{2}\right)}
Dans ces conditions, les grandeurs ne dépendent plus que d'une seule fraction molaire. La méthode de Roozeboom est ainsi ramenée au cas des mélanges binaires et l'on trace la grandeur molaire
Y
¯
{\displaystyle {\bar {Y}}}
x
2
{\displaystyle x_{2}}
x
1
/
x
3
{\displaystyle x_{1}/x_{3}}
abscisse
x
2
∘
{\displaystyle x_{2}^{\circ }}
corps
2
{\displaystyle 2}
vaut[ 5]
Y
¯
2
∘
=
Y
¯
∘
+
(
1
−
x
2
∘
)
(
∂
Y
¯
∂
x
2
)
P
,
T
,
x
1
/
x
3
∘
{\displaystyle {\bar {Y}}_{2}^{\circ }={\bar {Y}}^{\circ }+\left(1-x_{2}^{\circ }\right)\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T,x_{1}/x_{3}}^{\circ }}
et la tangente à la courbe a pour équation :
y
∘
(
x
2
)
=
(
∂
Y
¯
∂
x
2
)
P
,
T
,
x
1
/
x
3
∘
×
(
x
2
−
x
2
∘
)
+
Y
¯
∘
{\displaystyle y^{\circ }\!\left(x_{2}\right)=\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T,x_{1}/x_{3}}^{\circ }\times \left(x_{2}-x_{2}^{\circ }\right)+{\bar {Y}}^{\circ }}
En substituant la première relation dans la deuxième, on obtient l'équation de la tangente :
Tangente en
x
2
∘
{\displaystyle x_{2}^{\circ }}
y
∘
(
x
2
)
=
(
∂
Y
¯
∂
x
2
)
P
,
T
,
x
1
/
x
3
∘
×
(
x
2
−
1
)
+
Y
¯
2
∘
{\displaystyle y^{\circ }\!\left(x_{2}\right)=\left({\partial {\bar {Y}} \over \partial x_{2}}\right)_{P,T,x_{1}/x_{3}}^{\circ }\times \left(x_{2}-1\right)+{\bar {Y}}_{2}^{\circ }}
En
x
2
=
1
{\displaystyle x_{2}=1}
y
∘
(
1
)
=
Y
¯
2
∘
{\displaystyle y^{\circ }\!\left(1\right)={\bar {Y}}_{2}^{\circ }}
ordonnées du corps
2
{\displaystyle 2}
pur donne la grandeur molaire partielle du corps
2
{\displaystyle 2}
pour
x
2
∘
{\displaystyle x_{2}^{\circ }}
x
1
/
x
3
{\displaystyle x_{1}/x_{3}}
[ 5] [ 5]
Y
¯
{\displaystyle {\bar {Y}}}
x
1
{\displaystyle x_{1}}
x
2
/
x
3
{\displaystyle x_{2}/x_{3}}
x
1
∘
{\displaystyle x_{1}^{\circ }}
corps
1
{\displaystyle 1}
pur donne la grandeur molaire partielle
Y
¯
1
{\displaystyle {\bar {Y}}_{1}}
corps
1
{\displaystyle 1}
pour
x
1
∘
{\displaystyle x_{1}^{\circ }}
Y
¯
{\displaystyle {\bar {Y}}}
x
3
{\displaystyle x_{3}}
x
1
/
x
2
{\displaystyle x_{1}/x_{2}}
x
3
∘
{\displaystyle x_{3}^{\circ }}
corps
3
{\displaystyle 3}
pur donne la grandeur molaire partielle
Y
¯
3
{\displaystyle {\bar {Y}}_{3}}
corps
3
{\displaystyle 3}
pour
x
3
∘
{\displaystyle x_{3}^{\circ }}
[ 5] théorème d'Euler [ 5]
Y
¯
=
x
1
Y
¯
1
+
x
2
Y
¯
2
+
x
3
Y
¯
3
{\displaystyle {\bar {Y}}=x_{1}{\bar {Y}}_{1}+x_{2}{\bar {Y}}_{2}+x_{3}{\bar {Y}}_{3}}
Plus généralement, pour un mélange de
N
{\displaystyle N}
Y
¯
i
{\displaystyle {\bar {Y}}_{i}}
corps
i
{\displaystyle i}
quelconque, on choisit un corps
k
{\displaystyle k}
différent de
i
{\displaystyle i}
x
k
≠
0
{\displaystyle x_{k}\neq 0}
x
1
+
x
2
+
⋯
+
x
N
=
1
{\displaystyle x_{1}+x_{2}+\cdots +x_{N}=1}
x
i
+
x
k
(
x
1
x
k
+
x
2
x
k
+
⋯
+
x
i
−
1
x
k
+
x
i
+
1
x
k
+
⋯
+
x
N
x
k
)
=
1
{\displaystyle x_{i}+x_{k}\left({x_{1} \over x_{k}}+{x_{2} \over x_{k}}+\cdots +{x_{i-1} \over x_{k}}+{x_{i+1} \over x_{k}}+\cdots +{x_{N} \over x_{k}}\right)=1}
On fixe les ratios
x
1
x
k
,
⋯
,
x
i
−
1
x
k
,
x
i
+
1
x
k
,
⋯
,
x
N
x
k
{\displaystyle {x_{1} \over x_{k}},\cdots ,{x_{i-1} \over x_{k}},{x_{i+1} \over x_{k}},\cdots ,{x_{N} \over x_{k}}}
i
{\displaystyle i}
i
{\displaystyle i}
x
i
{\displaystyle x_{i}}
[ 6]
Y
¯
i
=
Y
¯
+
(
1
−
x
i
)
(
∂
Y
¯
∂
x
i
)
P
,
T
,
x
1
/
x
k
,
⋯
,
x
i
−
1
/
x
k
,
x
i
+
1
/
x
k
,
⋯
,
x
N
/
x
k
{\displaystyle {\bar {Y}}_{i}={\bar {Y}}+\left(1-x_{i}\right)\left({\partial {\bar {Y}} \over \partial x_{i}}\right)_{P,T,x_{1}/x_{k},\cdots ,x_{i-1}/x_{k},x_{i+1}/x_{k},\cdots ,x_{N}/x_{k}}}
Bernard Claudel, Propriétés thermodynamiques des fluides , vol. B 8020, Techniques de l'ingénieur , 1996 , 46 p. (lire en ligne ) .Jean Hertz, Diagrammes d'équilibre : alliages binaires , vol. M 70, Techniques de l'Ingénieur , 1999 , 30 p. (lire en ligne ) .(en) M. B. King, Phase Equilibrium in Mixtures , vol. 9, Elsevier, coll. « International Series of Monographs in Chemical Engineering », 2013 , 604 p. (ISBN 9781483152417 lire en ligne ) , p. 22-26Pierre Infelta et Michael Graetzel, Thermodynamique : Principes et Applications , Boca Raton, Floride, BrownWalker Press, 2006 , 484 p. (ISBN 1-58112-995-5 lire en ligne ) .Christian Picard, Thermochimie , De Boeck Supérieur, coll. « Bibliothèque des Universités - Chimie », 1996 (réimpr. 2000), 416 p. (ISBN 2-8041-2113-5 lire en ligne ) .