Oxalate de magnésium
| Oxalate de magnésium | |
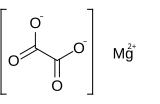
| |
| Identification | |
|---|---|
| Nom UICPA | oxalate de magnésium |
| Nom systématique | oxalate de magnésium |
| Synonymes |
|
| No CAS | 547-66-0[2]
|
| No ECHA | 100.008.121 |
| No CE | 208-932-1[3] |
| PubChem | 68353[1] |
| SMILES | |
| InChI | |
| Apparence | solide blanc [2] |
| Propriétés chimiques | |
| Formule |
|
| Masse molaire |
|
| Propriétés physiques | |
| T° fusion | entre 420 et 620 °C 150 °C (dihydrate) Les deux se décomposent[6] |
| Solubilité | 0,038 g/100 g H2O (anhydre et dihydraté)[2] |
| Masse volumique | 2,45 g/cm3[4] |
| Pression de vapeur saturante | 2,51 × 10−6 mmHg[3] |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'oxalate de magnésium est un composé inorganique ionique constitué d'un cation magnésium avec une charge 2+ lié à un anion oxalate. Il possède la formule chimique MgC2O4. L'oxalate de magnésium est un solide blanc qui existe sous deux formes : une forme anhydre et une forme dihydratée où deux molécules d'eau sont complexées avec la structure. Les deux formes sont pratiquement insolubles dans l'eau et dans les solutions organiques.
Occurrence naturelle[modifier | modifier le code]
Certains oxalates peuvent être trouvés dans la nature sous forme minérale, les plus répandus étant la whewellite et la weddellite, qui sont des oxalates de calcium. L'oxalate de magnésium se trouve naturellement près de Mill of Johnston qui est situé près de la ville d'Insch dans le nord-est de l'Écosse. Le minéral oxalate de magnésium est appelé glushinskite. L'oxalate de magnésium se trouve à l'interface entre le lichen et le rocher sur la serpentinite. Il a été trouvé dans une couche blanche crémeuse qui était mélangée au champignon du lichen. Une image au microscope électronique à balayage d'échantillons a montré que les cristaux avaient une structure pyramidale avec des faces à la fois courbes et striées. La taille de ces cristaux allait de 2 à 5 μm[7].
Synthèse et réactions[modifier | modifier le code]
L'oxalate de magnésium peut être synthétisé en combinant un sel ou un ion de magnésium avec un oxalate.
- Mg2++C2O42− → MgC2O4
Un exemple particulier de synthèse serait obtenu en mélangeant Mg(NO3)2 et KOH puis en ajoutant cette solution à (COOH)2[8].
L'oxalate de magnésium se décompose lorsqu'il est chauffé. En premier lieu, le dihydrate se décompose à 150 °C sous la forme anhydre.
- MgC2O4•2H2O → MgC2O4 + 2H2O
Si on continue à chauffer, la forme anhydre se décompose en oxyde de magnésium et en oxydes de carbone entre 420 et 620 °C. Il se forme tout d'abord du monoxyde de carbone et du carbonate de magnésium. Ensuite, le monoxyde de carbone s'oxyde en dioxyde de carbone et le carbonate de magnésium se décompose en oxyde de magnésium et en dioxyde de carbone[6].
- MgC2O4 → MgCO3 + CO
- CO + 1/2O2 → CO2
- MgCO3 → MgO + CO2
L'oxalate de magnésium dihydraté a également été utilisé dans la synthèse de l'oxyde de magnésium sous forme nanométrique. L'oxyde de magnésium est important car il est utilisé comme catalyseur, matériau réfractaire, adsorbant, supraconducteur et matériau ferroélectrique. Les nano-particules d'oxyde de magnésium sont optimales pour certains de ces usages à cause de leur rapport plus élevé entre la surface et le volume, comparé aux particules de plus grande taille. La plupart des méthodes de synthèse de l'oxyde de magnésium produisent des particules de grande taille, cependant le procédé sol-gel utilisant l'oxalate de magnésium produit des particules nanométriques d'oxyde de magnésium très stables. Le procédé sol-gel implique la combinaison d'un sel de magnésium, dans ce cas l'oxalate de magnésium, avec un agent gélifiant. Ce procédé produit effectivement des nano-particules d'oxyde de magnésium[9].
Santé et sécurité[modifier | modifier le code]
L'oxalate de magnésium est un irritant de la peau et des yeux.
Références[modifier | modifier le code]
- « Oxalates-Compound Summary » (consulté le )
- CRC Handbook of Chemistry and Physics, 2012–2013, 93e éd.
- « Magnesium Oxalate Chemical Formula, Chemical CAS 547-66-0 » (consulté le )
- « Magnesium Oxalate » (consulté le )
- « Magnesium Oxalate » (consulté le )
- Ahmed Gadala, « Kinetics of the Decomposition of Hydrated Oxalates of Calcium and Magnesium in Air », Thermochimica Acta, vol. 74, , p. 255–272 (DOI 10.1016/0040-6031(84)80027-1)
- M Wilson, D. Jones et D.J. Russell, « Glushinskite, a naturally occurring magnesium oxalate », Mineralogical Magazine, vol. 43, , p. 837–840 (DOI 10.1180/minmag.1980.043.331.02)
- Yoshio Masuda, « Kinetics of the Thermal Dehydration of Magnesium Oxalate Dihydrate in a Flowing Atmosphere of Dry Nitrogen », J. Phys. Chem., vol. 91, , p. 6543–6547 (DOI 10.1021/j100310a024)
- Mohd Mastuli, Roshidah Rusdi, Annie Mahat, Norazira Saat et Norlida Kamarulzaman, « Sol-Gel Synthesis of Highly Stable Nano Sized MgO from Magnesium Oxalate Dihydrate », Advanced Materials Research, vol. 545, , p. 137–142 (DOI 10.4028/www.scientific.net/amr.545.137)
