Oxydation de Swern
L’oxydation de Swern est l'oxydation douce des alcools primaires et secondaires en aldéhyde et en cétone dans un milieu contenant du chlorure d'oxalyle, du diméthylsulfoxyde (DMSO) et de la triéthylamine. Daniel Swern a donné son nom à la réaction[1].
L'avantage principal de cette méthode réside dans la douceur des conditions qui compense l'utilisation de réactifs toxiques (chlorure d'oxalyle, diméthylsulfoxyde, dégagement de monoxyde de carbone). Il est de plus impossible d'observer l'oxydation supplémentaire en acide carboxylique dans le cas de l'oxydation d'un alcool primaire. Cette méthode est très souvent utilisée dans la synthèse totale de produits naturels.
Les sous-produits sont le sulfure de diméthyle (Me2S), le monoxyde de carbone (CO), le dioxyde de carbone (CO2) et — quand la triéthylamine est utilisée comme base — le chlorure de triéthylammonium (Et3NHCl). Deux d'entre eux, Me2S et CO, sont très toxiques et volatils : la réaction doit être réalisée sous hotte. Me2S est un liquide volatil (Téb = 37 °C) à l'odeur déplaisante : un moyen de limiter cette odeur est de le traiter à l'ozone pour le transformer en diméthylsulfoxyde, inodore.
Mécanisme[modifier | modifier le code]
La première étape de l'oxydation de Swern est la réaction, à basse température, du diméthylsulfoxyde (DMSO) 1a et 1b avec le chlorure d'oxalyle, 2. Le premier intermédiaire, 3, se décompose rapidement, libérant des oxydes de carbone (CO et CO2) et produisant le chlorure de diméthylchlorosulfonium, 4.
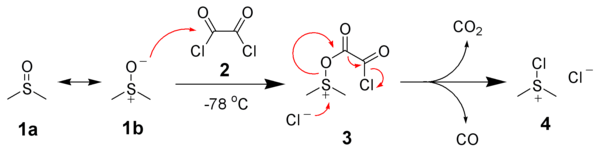
Le chlorure de diméthylchlorosulfonium 4 réagit ensuite avec l'alcool 5 pour donner l'intermédiaire ionique alkoxysulfonium, 6. L'ajout d'au moins deux équivalents de base — typiquement la triéthylamine — va déprotoner l'ion alkoxysulfonium pour donner l'ylure de soufre, 7. Dans un état de transition comportant un cycle à cinq membres, l'ylure de soufre se décompose pour donner le sulfure de diméthyle (Me2S) et l'aldéhyde ou la cétone recherchée, 8.

Variantes[modifier | modifier le code]
Lorsqu'on utilise le chlorure d'oxalyle comme agent de déshydratation, la réaction doit être maintenue à une température inférieure à −60 °C pour éviter les réactions secondaires. En utilisant l'anhydride trifluoroacétique à la place du chlorure d'oxalyle, la température peut être augmentée à −30 °C sans réactions secondaires. On peut également activer le DMSO pour initier la formation de l'intermédiaire 6 avec des carbodiimides (oxydation de Pfitzner-Moffatt) ou un complexe trioxyde de soufre-pyridine (oxydation de Parikh-Doering).
Dans certains cas, l'utilisation de triéthylamine en tant que base peut conduire à l'épimérisation du carbone α du carbonyle nouvellement formé. L'utilisation du diisopropyléthylamine (i-Pr2NEt, base de Hünig), plus encombrant, peut tempérer cet effet non désiré.
Remarque[modifier | modifier le code]
Le sulfure de diméthyle, sous-produit de cette réaction, a une odeur très désagréable. Les glandes olfactives humaines sont d'ailleurs capables de détecter ce composé dans des concentrations de l'ordre de quelques parts par milliard. Une solution simple à ce problème incommodant est de rincer la verrerie à l'eau de Javel, capable d'oxyder le sulfure de diméthyle et ainsi d'éliminer l'odeur.
Références[modifier | modifier le code]
- (en) Anthony J. Mancuso, Shui-Lung Huang et Daniel Swern, « Oxidation of long-chain and related alcohols to carbonyls by dimethyl sulfoxide activated by oxalyl chloride », The Journal of Organic Chemistry, vol. 43, no 12, , p. 2480–2482 (ISSN 0022-3263 et 1520-6904, DOI 10.1021/jo00406a041).
