Pentraxine
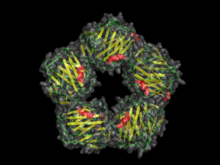
Les pentraxines (PTX), également connues sous le nom de pentaxines, sont une famille évolutive conservée de protéines caractérisées par le fait qu'elles contiennent un domaine protéique de pentraxine. Les protéines de la famille des pentraxines sont impliquées dans les réponses immunologiques aiguës[1]. Ils sont une classe de récepteurs de reconnaissance de formes (PRR). Ils constituent une superfamille de protéines conservées multifonctionnelles, dont certaines sont des composants du bras humoral de l'immunité innée et se comportent comme des ancêtres fonctionnels des anticorps. Elles sont connues sous le nom de protéines de phase aiguë classiques (APP), connues depuis plus d'un siècle[2].
Structure[modifier | modifier le code]
Les pentraxines sont caractérisées par une liaison au ligand dépendante du calcium et une structure β-jellyroll aplatie caractéristique similaire à celle des lectines de légumineuses[3]. Le nom "pentraxine" est dérivé du mot grec pour cinq (penta) et axe (axe) relatif à la symétrie radiale de cinq monomères formant un anneau d'environ 95 Å de diamètre et 35 Å de profondeur observé chez les premiers membres de cette famille à identifier. Les pentraxines "courtes" comprennent le composant sérique amyloïde P (SAP) et la protéine C réactive (CRP). Les pentraxines "longues" comprennent la PTX3 (une molécule modulée par les cytokines) et plusieurs pentraxines neuronales.
Membres de la famille[modifier | modifier le code]
Trois des principaux membres de la famille des pentraxines sont des protéines sériques : à savoir, la CRP[4], SAP[5], et la protéine femelle de hamster (FP)[6]. La protéine PTX3 (ou TSG-14) est une protéine induite par les cytokines qui est homologue aux CRP et aux SAP, mais sa fonction n'a pas encore été déterminée.
Protéine C-réactive[modifier | modifier le code]
La protéine C-réactive est exprimée au cours de la phase aiguë de réponse à une lésion tissulaire ou à une inflammation chez les mammifères. La protéine ressemble à un anticorps et remplit plusieurs fonctions associées à la défense de l'hôte : elle favorise l'agglutination, le gonflement capsulaire bactérien et la phagocytose, et active la voie classique du complément par sa liaison dépendante du calcium à la phosphocholine[4]. Les CRP ont également été séquencés chez un invertébré, Limulus polyphemus (limule de l'Atlantique), où ils sont un constituant normal de l'hémolymphe.
Pentraxine 3[modifier | modifier le code]
La pentraxine 3 (PTX3) est une protéine de phase aiguë dont les niveaux augmentent lors d'infections graves chez l'homme. En cas d'infections du système nerveux central, PTX3 aide à distinguer la méningo-encéphalite bactérienne de la méningo-encéphalite aseptique. Elle est significativement plus élevée dans les méningo-encéphalites bactériennes[7].
Composant amyloïde P sérique[modifier | modifier le code]
Le composant amyloïde P sérique est une protéine de vertébré identique aux formes tissulaires du composant amyloïde P. On le trouve dans tous les types de dépôts amyloïdes, dans la membrane basale glomérulaire et dans les fibres élastiques des vaisseaux sanguins. SAP se lie à divers ligands lipoprotéiques d'une manière dépendante du calcium, et il a été suggéré que, chez les mammifères, cela pourrait avoir des implications importantes dans l'athérosclérose et l'amylose[5].
Protéine femelle de hamster[modifier | modifier le code]
La protéine femelle de hamster est un homologue de SAP trouvé dans Mesocricetus auratus (le hamster doré). La concentration de cette protéine plasmatique est modifiée par les stéroïdes sexuels et les stimuli qui déclenchent une réponse de phase aiguë[6].
Système nerveux[modifier | modifier le code]
Les protéines de la pentraxine exprimées dans le système nerveux sont la pentraxine neurale I (NPTXI) et II (NPTXII)[8]. NPTXI et NPTXII sont homologues et peuvent exister au sein d'une même espèce. Il est suggéré que les deux protéines interviennent dans l'absorption des macromolécules synaptiques et jouent un rôle dans la plasticité synaptique. L'apexine, une protéine acrosomique du sperme, est un homologue du NPTXII trouvé dans Cavia porcellus (cochon d'Inde)[9].
Humain[modifier | modifier le code]
Les gènes humains codant pour les protéines qui contiennent ce domaine comprennent :
Notes et références[modifier | modifier le code]
- « Structure and function of the pentraxins », Current Opinion in Immunology, vol. 7, no 1, , p. 54–64 (PMID 7772283, DOI 10.1016/0952-7915(95)80029-8)
- « Evolution of the pentraxin family: the new entry PTX4 », Journal of Immunology, vol. 184, no 9, , p. 5055–64 (PMID 20357257, DOI 10.4049/jimmunol.0901672)
- « Structure of pentameric human serum amyloid P component », Nature, vol. 367, no 6461, , p. 338–45 (PMID 8114934, DOI 10.1038/367338a0, Bibcode 1994Natur.367..338E, S2CID 4284282)
- « Inflammatory potential of C-reactive protein complexes compared to immune complexes », Clinical Immunology and Immunopathology, vol. 87, no 2, , p. 155–62 (PMID 9614930, DOI 10.1006/clin.1997.4516)
- « Serum amyloid P component associates with high density lipoprotein as well as very low density lipoprotein but not with low density lipoprotein », Biochemical and Biophysical Research Communications, vol. 244, no 1, , p. 249–52 (PMID 9514915, DOI 10.1006/bbrc.1998.8248)
- « Electrophoretic polymorphism of a hamster pentraxin, female protein (amyloid P component) », Scandinavian Journal of Immunology, vol. 46, no 2, , p. 180–6 (PMID 9583999, DOI 10.1046/j.1365-3083.1997.d01-109.x, S2CID 6361670)
- « Determination of pentraxin 3 levels in cerebrospinal fluid during central nervous system infections », European Journal of Clinical Microbiology & Infectious Diseases, vol. 39, no 4, , p. 665–670 (PMID 31813079, DOI 10.1007/s10096-019-03767-w, hdl 11368/2972747, S2CID 208812200)
- « Mouse and human neuronal pentraxin 1 (NPTX1): conservation, genomic structure, and chromosomal localization », Genomics, vol. 36, no 3, , p. 543–5 (PMID 8884281, DOI 10.1006/geno.1996.0503)
- « Apexin, an acrosomal pentaxin », The Journal of Biological Chemistry, vol. 269, no 51, , p. 32615–20 (PMID 7798266)
