Peroxyde de carbamide
Le couplage peroxyde d'hydrogène - urée (également appelé hyperol ou artizone) est un solide composé de peroxyde d'hydrogène et d'urée. C'est un solide cristallin blanc qui se dissout dans l'eau pour donner du peroxyde d'hydrogène libre. Souvent appelé peroxyde de carbamide dans les cabinets dentaires, il est utilisé comme une source de peroxyde d'hydrogène pour le blanchiment, la désinfection et l'oxydation. Le peroxyde de carbamide contient du peroxyde d'hydrogène solide, libérable dans l'eau, il offre ainsi une plus grande stabilité et une meilleure contrôlabilité comparé au peroxyde d'hydrogène liquide lorsqu'il est utilisé comme agent oxydant.
Production[modifier | modifier le code]
Pour la préparation du composé, de l'urée (qui est stable avec les agents oxydants tels que le peroxyde d'hydrogène) est dissous dans 30 % de peroxyde d'hydrogène (rapport molaire de 2:3) à des températures inférieures à 60 °C. En refroidissant, le peroxyde d'hydrogène et l'urée précipitent sous la forme de petites plaquettes[1].

La détermination de la quantité de peroxyde d'hydrogène par titrage avec une solution de permanganate de potassium donne une valeur de 35,4 %, ce qui correspond à 97,8 % de la valeur maximale théorique. Le reste de l'impureté se compose d'urée.
L'adduit peut être stabilisé par l'ajout d'environ 1 % de pyrophosphate de sodium, hexamétaphosphate de sodium, d'acide dihydroxybutanedioic ou d'EDTA-Na2, puisque ceux-ci complexent les ions de métaux lourds catalytiquement actifs qui pourraient déstabiliser la molécule.
Le peroxyde d'hydrogène cristallise avec l'urée dans une stœchiométrie 1:1. Le composé est simplement produit (de l'ordre de plusieurs centaines de tonnes par an) par la dissolution de l'urée dans un excès de peroxyde d'hydrogène concentré en solution, suivie de la cristallisation[2]. La synthèse en laboratoire est analogue[3].
Structure et propriétés[modifier | modifier le code]
Le peroxyde d'hydrogène-urée est facilement soluble dans l'eau, inodore, solide cristallin, qui est disponible en tant que poudre blanche ou des aiguilles ou de plaquettes incolores. Lors de la dissolution dans divers solvants, le complexe de rapport 1:1 se dissocie redonnant de l'urée et du peroxyde d'hydrogène. Ainsi, tout comme le peroxyde d'hydrogène, l'adduit est un oxydant , mais sa décomposition à température ambiante en présence de catalyseurs se fait d'une manière contrôlée, ainsi le composé est conçu comme un remplacement plus sécurisé qu'une solution aqueuse de peroxyde d'hydrogène, qui est instable. En raison de la tendance à la décomposition thermique, qui s'accélère à des températures supérieures à 82 °C[4], il ne doit pas être chauffé au-dessus de 60 °C, en particulier à l'état pur.
La solubilité des échantillons commerciaux varie de 0,05 g/ml[5] à plus de 0,6 g/ml[6]. La structure de l'état solide de cet adduit a été déterminée par diffraction de neutrons[7].
Utilisation[modifier | modifier le code]
Désinfectant et agent de blanchiment[modifier | modifier le code]
Le peroxyde d'hydrogène-urée est principalement utilisé comme un désinfectant et un agent de blanchiment dans les cosmétiques et les produits pharmaceutiques. En tant que médicament, ce composé est utilisé dans certaines préparations pour le blanchiment des dents[8],[9]. Il est également utilisé pour soulager l'inflammation mineure des gencives, de la muqueuse buccale et les lèvres, notamment les aphtes et les irritations dentaires[10] et pour émulsionner et disperser le cérumen[11].
Le peroxyde de Carbamide est également utilisé comme un désinfectant, par exemple pour réduire les germes des lentilles de contact ou comme antiseptique pour les bains de bouche, des gouttes pour les oreilles ou pour les plaies superficielles et des ulcères.
Réaction dans des synthèses organiques[modifier | modifier le code]
Dans les laboratoires, il est utilisé comme un remplaçant, plus facilement manipulé, du peroxyde d'hydrogène[12],[13]. Il s'est avéré être un agent oxydant stable, facile à manipuler et efficace, qui est facilement contrôlable par un choix approprié des conditions de réaction. Il offre des produits d'oxydation respectueux de l'environnement et, a souvent, des rendements élevés en particulier en présence de catalyseurs organiques tels que l'anhydride cis-butènedioïque[14] ou de catalyseurs inorganiques tels que le tungstate de sodium[15].


Il convertit les thiols de manière sélective en disulfures, les alcools secondaires en cétones, les sulfures en sulfoxydes et sulfones[16], les nitriles en amides[17], les hétérocycles azotés en amine oxydes[18], les hydroxyaldéhydes aromatiques en diphénols (oxydation de Dakin)[19] et donne, dans des conditions appropriées l'acide benzoïque correspondant.

Il oxyde les cétones en esters, en particulier les cétones cycliques, telles que les cyclohexanones[20] ou cyclobutanones[21] pour donner des lactones (réarrangement de Baeyer-Villiger).
Il permet l'époxydation de différents alcènes en présence de benzonitrile donnant des oxiranes avec des rendements de 79 à 96 %[22].
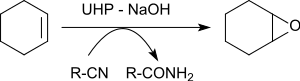
L'atome d'oxygène transféré à l'alcène est originaire d'un produit intermédiaire temporaire formé à partir du benzonitrile. L'acide iminé résultant se tautomérise en benzamide.
Sécurité[modifier | modifier le code]
Le composé agit comme un puissant oxydant et peut causer des irritations de la peau et des lésions oculaires graves.
Références[modifier | modifier le code]
- C.-S. Lu, E.W. Hughes et P.A. Giguère, « The crystal structure of the urea-hydrogen peroxide addition compound CO(NH2)2 H2O2 », J. Am. Chem. Soc., vol. 63, no 6, , p. 1507–1513 (DOI 10.1021/ja01851a007)
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a19_177.pub2), « Peroxo Compounds, Inorganic »
- Lei Yu, Bo Meng et Xian Huang, « Urea-Hydrogen Peroxide Complex: A Selective Oxidant in the Synthesis of 2-Phenylselenyl-1,3-butadienes », Synthetic Communications, vol. 38, no 18, , p. 3142 (DOI 10.1080/00397910802109224)
- H. Heaney, F. Cardona, A. Goti et A.L. Frederick, « Hydrogen Peroxide-Urea », e-EROS Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rh047.pub3)
- Sigma-Aldrich specification sheet
- Chemicalland data sheet
- C.J. Fritchie, Jr. et R.K. McMullan, « Neutron diffraction study of the 1:1 urea:hydrogen peroxide complex at 81 K », Acta Crystallographica Section B, vol. 37, no 5, , p. 1086 (DOI 10.1107/S0567740881005116)
- GR Mokhlis, BA Matis, MA Cochran et GJ Eckert, « A Clinical Evaluation of Carbamide Peroxide and Hydrogen Peroxide Whitening Agents during Daytime Use », Journal of the American Dental Association (1939), vol. 131, no 9, , p. 1269–77 (PMID 10986827, DOI 10.14219/jada.archive.2000.0380, lire en ligne [archive du ])
- Toothwhitening « Copie archivée » (version du sur Internet Archive) from the UMF of New Jersey website
- Center for Integrative Medicine: Carbamide Peroxide from the University of Maryland Medical Center website « https://web.archive.org/web/20071018153839/http://www.umm.edu/altmed/drugs/carbamide-peroxide-021300.htm »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?),
- « Carbamide peroxide (Into the ear) », sur Umm.edu, University of Maryland Medical Center (consulté le )
- Rajender S. Varma et Kannan P. Naicker, « The Urea−Hydrogen Peroxide Complex: Solid-State Oxidative Protocols for Hydroxylated Aldehydes and Ketones (Dakin Reaction), Nitriles, Sulfides, and Nitrogen Heterocycles », Organic Letters, vol. 1, no 2, , p. 189 (DOI 10.1021/ol990522n)
- Harry Heaney, Francesca Cardona et Andrea Goti, Hydrogen Peroxide–Urea, Encyclopedia of Reagents for Organic Synthesis, 2008, DOI 10.1002/047084289X.rh047.pub2
- (de) B. Karami, M. Montazerozohori et M. H. Habibi, « Urea-Hydrogen Peroxide (UHP) oxidation of thiols to the corresponding disulfides promoted by maleic anhydride as mediator », molecules, vol. 10, no 10, , p. 1358–1363 (DOI 10.3390/10101385, lire en ligne)
- (en) M. Lukasiewicz et D. Bogdal, « Microwave-assisted oxidation of alcohols using urea hydrogen peroxide » (consulté le )
- R.S. Varma et K.P. Naicker, « The Urea-Hydrogen Peroxide Complex: Solid-State Oxidative Protocols for Hydroxylated Aldehydes and Ketones (Dakin Reaction), Nitriles, Sulfides, and Nitrogen Heterocycles », Org. Lett., vol. 1, no 2, , p. 189–191 (DOI 10.1021/ol990522n)
- Brevet
- (de) D. Rong, V.A. Phillips, R.S. Rubio, M.A. Castro et R.T. Wheelhouse, « A safe, convenient and efficient method for the preparation of heterocyclic N-oxides using urea-hydrogen peroxide », Tetrahedron Lett., vol. 49, no 48, , p. 6933–6935
- H. Heaney et A.J. Newbold, « The oxidation of aromatic aldehydes by magnesium monoperoxyphthalate and urea-hydrogen peroxide », Tetrahedron Lett., vol. 42, no 37, , p. 6607–6609 (DOI 10.1016/S0040-4039(01)01332-6)
- (de) M.Y. Rios, E. Salazar et H.F. Olivo, « Baeyer–Villiger oxidation of substituted cyclohexanones via lipase-mediated perhydrolysis utilizing urea–hydrogen peroxide in ethyl acetate », Green Chem., vol. 9, no 5, , p. 459–462 (DOI 10.1039/B618175A)
- (de) A. Watanabe, T. Uchida, K. Ito et T. Katsuki, « Highly enantioselective Baeyer-Villiger oxidation using Zr(salen) complex as catalyst », Tetrahedron Lett., vol. 43, no 25, , p. 4481–4485 (DOI 10.1016/S0040-4039(02)00831-6)
- (de) L. Ji, Y.-N. Wang, C. Qian et X.-Z. Chen, « Nitrile-promoted alkene epoxidation with urea-hydrogen peroxide (UHP) », Synth. Commun., vol. 43, no 16, , p. 2256–2264 (DOI 10.1080/00397911.2012.699578)
