Peroxyde organique

En chimie organique, les peroxydes organiques sont des composés organiques contenant le groupe fonctionnel peroxyde (R-O-O-R'). Si le R′ est de l'hydrogène, de tels composés sont appelés hydroperoxydes. La liaison O−O des peroxydes se brise facilement, produisant des radicaux libres de la forme RO. (le point représente un électron célibataire). Ainsi, les peroxydes organiques sont utiles comme amorceurs pour certains types de polymérisation, tels que les résines acryliques, polyesters insaturés et vinylesters utilisés dans les plastiques à renfort de verre. Le MEKP et le peroxyde de benzoyle sont couramment utilisés à cette fin. Cependant, cette même propriété signifie également que les peroxydes organiques peuvent s’enflammer de manière explosive. Les peroxydes organiques, comme leurs homologues inorganiques, sont souvent de puissants agents de blanchiment[1].
Les peroxydes organiques sont classés (i) selon la présence ou l'absence d'une extrémité hydroxyle (-OH) et (ii) selon la présence de substituants alkyle ou acyle[2].
- Exemples de peroxydes organiques
-
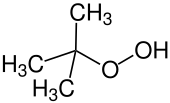
Hydroperoxyde de tert-butyle, un hydroperoxyde (formule : ROOH), qui est utilisé pour époxyder les alcènes.
-
Peroxyde de dicumyle, un peroxyde de dialkyle (formule : ROOR), qui est utilisé pour initier les polymérisations.
-
tert-butylperoxybenzoate, un peroxyester (formule : RCO3R') utilisé comme amorceur de radicaux.
-
peroxyde de dibenzoyle, un peroxyde de diacyle (formule : (RCO2)2) est également utilisé comme amorceur de polymérisations.
-
Acide peroxyacétique, un acide peroxycarboxylique[formule : (RCO3H)], est un réactif en synthèse organique.
Une lacune dans les classes de peroxydes organiques est le peroxyde de diphényle. Les calculs de chimie quantique prédisent qu'il subit une réaction très proche du mécanisme de réarrangement de la benzidine[3].
Propriétés[modifier | modifier le code]
La longueur de la liaison O−O dans les peroxydes est d'environ 1,45 Å, et les angles R−O−O (R = H, C) sont d'environ 110° (comme l'eau). De manière caractéristique, les angles dièdres C−O−O−R (R = H, C) sont d'environ 120°. La liaison O−O est relativement faible, avec une énergie de dissociation de la liaison de 45-50 kcal/mole, soit moins de la moitié de la force des liaisons C−C, C−H et C−O[4],[5].

Les peroxydes jouent un rôle important en biologie. Des centaines de peroxydes et d'hydroperoxydes sont connus, dérivés d'acides gras, de stéroïdes et de terpènes[6]. Les prostaglandines sont biosynthétisées par formation initiale d'un peroxyde bicyclique (« endoperoxyde ») dérivé de l'acide arachidonique[7].
De nombreux aspects de la biodégradation ou du vieillissement sont attribués à la formation et à la désintégration des peroxydes formés à partir de l'oxygène de l'air. Pour contrer ces effets, une gamme d’antioxydants biologiques et artificiels détruisent les peroxydes.
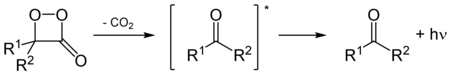
Chez les lucioles, l'oxydation des luciférines, catalysée par les luciférases, donne un composé peroxy 1,2-dioxétane. Le dioxétane est instable et se désintègre spontanément en dioxyde de carbone et en cétones excitées, qui libèrent un excès d'énergie en émettant de la lumière (bioluminescence)[8].
Utilisations industrielles[modifier | modifier le code]
En chimie des polymères[modifier | modifier le code]
De nombreux peroxydes sont utilisés comme amorceurs radicalaires, par exemple pour permettre la polymérisation des acrylates. Les résines industrielles à base d'esters d'acide acrylique ou méthacrylique sont invariablement produites par polymérisation radicalaire avec des peroxydes organiques à des températures élevées[9]. La vitesse de polymérisation est ajustée par un choix approprié de température et de type de peroxyde[10].
Le peroxyde de méthyléthylcétone, le peroxyde de benzoyle et, dans une moindre mesure, le peroxyde d'acétone sont utilisés comme amorceurs pour la polymérisation radicalaire de certains thermodurcissables, par exemple les résines de polyester et d'ester vinylique insaturées, souvent rencontrées lors de la fabrication de composites en fibres de verre ou en fibre de carbone, avec des exemples incluant les bateaux, camping-cars, baignoires, piscines, équipements sportifs, pales d'éoliennes et une variété d'applications industrielles.
Le peroxyde de benzoyle, les peroxyesters / kétal-peroxy et les monocarbonates d'alkylperoxy sont utilisés dans la production de polystyrène, de polystyrène expansé et de polystyrène choc, et le peroxyde de benzoyle est utilisé pour de nombreuses applications d'adhésifs à base d'acrylate.
Les techniques de production de thermoplastiques pour de nombreuses applications de polymérisation industrielle comprennent des processus qui sont réalisés en masse, en solution ou en suspension. Les polymères concernés comprennent : le polychlorure de vinyle (PVC), le polyéthylène basse densité (LDPE), le polyéthylène haute densité (HDPE), le polyméthacrylate de méthyle (PMMA), le polystyrène et les polycarbonates.
Agents de blanchiment et désinfectants[modifier | modifier le code]
Le peroxyde de benzoyle et le peroxyde d'hydrogène sont utilisés comme agents de blanchiment et de « maturation » pour traiter la farine afin que ses grains libèrent plus facilement le gluten ; L'alternative consiste à laisser la farine s'oxyder lentement par l'air, ce qui est trop lent pour l'ère industrialisée. Le peroxyde de benzoyle est un médicament topique efficace pour traiter la plupart des formes d'acné.
Préparation[modifier | modifier le code]
Du peroxyde d'hydrogène[modifier | modifier le code]
Les peroxydes de dialkyle, par exemple le peroxyde de dicumyle, sont synthétisés par addition de peroxyde d'hydrogène à des alcènes ou par O-alkylation d'hydroperoxydes.
Les peroxydes de diacyle sont généralement préparés en traitant le peroxyde d'hydrogène avec des chlorures d'acide ou des anhydrides d'acide en présence de base[1] :
- H2O2 + 2 RCOCl -> (RCO2)2 + 2 HCl
- H2O2 + (RCO)2O -> (RCO2)2 + H2O
La réaction entre en compétition avec l'hydrolyse de l'agent acylant mais l'anion hydroperoxyde est un nucléophile supérieur à l'hydroxyde. Des peroxydes de diacyle asymétriques peuvent être produits en traitant des chlorures d'acyle avec le peroxyacide.
Les peresters, par exemple le peroxybenzoate de tert -butyle, sont produits en traitant des anhydrides d'acide ou des chlorures d'acide avec des hydroperoxydes.
De O2[modifier | modifier le code]
Les peroxydes cycliques peuvent être obtenus par cycloaddition d'oxygène singulet (généré par rayonnement UV) aux diènes. Un exemple important est le rubrène. Les peroxydes cycliques à six chaînons sont appelés endoperoxydes[11]. Les dioxétanes à quatre chaînons peuvent être obtenus par cycloaddition 2+2 d'oxygène sur des alcènes[12],[13].
Les dangers associés au stockage des éthers dans l'air sont attribués à la formation d'hydroperoxydes via la réaction directe quoique lente de l'oxygène triplet avec les liaisons C-H.
Réactions[modifier | modifier le code]
Homolyse[modifier | modifier le code]
Les peroxydes organiques sont largement utilisés pour initier la polymérisation des alcènes, par exemple la formation de polyéthylène. Une étape-clé est l’homolyse :
- ROOR ⥃ 2 RO.
La tendance à l'homolyse est également exploitée pour modifier des polymères par greffage ou viscoréduction, ou réticuler des polymères pour créer un thermodurcissable. Lorsqu'il est utilisé à ces fins, le peroxyde est fortement dilué, de sorte que la chaleur générée par la décomposition exothermique est absorbée en toute sécurité par le milieu environnant (par exemple, composé polymère ou émulsion ).
Auto-oxydation[modifier | modifier le code]
Surtout lorsqu'ils sont sous forme concentrée, les peroxydes organiques peuvent se décomposer par auto-oxydation, car les peroxydes organiques contiennent à la fois un oxydant (la liaison OO) et un combustible (les liaisons CH et CC). Une « décomposition auto-accélérée » se produit lorsque le taux de décomposition du peroxyde génère de la chaleur à un rythme plus rapide qu'elle ne peut être dissipée dans l'environnement. La température est le principal facteur du taux de décomposition. La température la plus basse à laquelle un peroxyde organique conditionné subira une décomposition auto-accélérée en une semaine est définie comme la température de décomposition auto-accélérée (SADT). Un incendie majeur survenu à l'usine chimique Arkema à Crosby, Texas (États-Unis) en 2017, a été provoqué par la décomposition de divers peroxydes organiques suite à une panne de courant et à la perte ultérieure des systèmes de refroidissement[14]. Cela s'est produit en raison des inondations extrêmes causées par l'ouragan Harvey, qui a détruit les générateurs électriques principaux et de secours sur le site[14].
Procédé au cumène[modifier | modifier le code]
Les hydroperoxydes sont des intermédiaires ou des réactifs dans les principaux procédés commerciaux. Dans le procédé au cumène, l'acétone et le phénol sont produits par décomposition de l'hydroperoxyde de cumène (Me = méthyle) :
- C6H5CMe2(O2H) -> C6H5OH + O=CMe2
Réduction[modifier | modifier le code]
Les organoperoxydes peuvent être réduits en alcools avec du tétrahydruroaluminate de lithium, comme décrit dans cette équation idéalisée :
- 4 ROOH + LiAlH4 -> LiAlO2 + 2 H2O + 4 ROH
Les esters de phosphite et les phosphines tertiaires entraînent également une réduction :
- ROOH + PR3 -> P(OR)3 + ROH
Le clivage en cétones et alcools se produit dans le réarrangement de Kornblum–DeLaMare catalysé par des bases, impliquant la rupture des liaisons au sein des peroxydes pour former ces produits.
Certains peroxydes sont des médicaments dont l'action repose sur la formation de radicaux à des endroits souhaités de l'organisme. Par exemple, l'artémisinine et ses dérivés, comme l'artésunate, possèdent l'action la plus rapide de tous les médicaments actuels contre le paludisme à falciparum[15]. L'artésunate est également efficace pour réduire la production d'œufs en cas d'infection à Schistosoma haematobium[16].
Synthèse organique[modifier | modifier le code]
L'hydroperoxyde de tert-butyle est utilisé pour les réactifs d'époxydation et d'hydroxylation en conjonction avec des catalyseurs métalliques[17].
Analyse des peroxydes[modifier | modifier le code]

Plusieurs méthodes analytiques sont utilisées pour la détermination qualitative et quantitative des peroxydes[18]. Une simple détection qualitative des peroxydes est réalisée avec le test à l'iode-amidon[19]. Ici, les peroxydes, les hydroperoxydes ou les peracides oxydent l'iodure de potassium ajouté en iode, qui réagit avec l'amidon en produisant une couleur bleu foncé. Des indicateurs de papier commercial utilisant cette réaction sont disponibles. Cette méthode convient également à l’évaluation quantitative, mais elle ne permet pas de distinguer les différents types de composés peroxydés. La décoloration de divers colorants indigo en présence de peroxydes est utilisée à cette fin[20]. Par exemple, la perte de couleur bleue dans le bleu de leucométhylène est sélective pour le peroxyde d’hydrogène[21].
L'analyse quantitative des hydroperoxydes peut être effectuée par titrage potentiométrique avec du tétrahydruroaluminate de lithium[22]. Une autre façon d'évaluer la teneur en peracides et peroxydes est le titrage volumétrique avec des alcoolates tels que l'éthoxyde de sodium[23].
Oxygène actif dans les peroxydes[modifier | modifier le code]
Chaque groupe peroxy est considéré comme contenant un atome d’oxygène actif. Le concept de teneur en oxygène actif est utile pour comparer la concentration relative de groupes peroxy dans les formulations, qui est liée à la teneur énergétique. En général, la teneur en énergie augmente avec la teneur en oxygène actif, et donc plus le poids moléculaire des groupes organiques est élevé, plus la teneur en énergie est faible et, généralement, plus le risque est faible.
Le terme oxygène actif est utilisé pour spécifier la quantité de peroxyde présente dans toute formulation de peroxyde organique. L'un des atomes d'oxygène de chaque groupe peroxyde est considéré comme « actif ». La quantité théorique d'oxygène actif peut être décrite par l'équation suivante [24]:
où p est le nombre de groupes peroxydes dans la molécule et m est la masse moléculaire du peroxyde pur.
Les peroxydes organiques sont souvent vendus sous forme de formulations comprenant un ou plusieurs agents flegmatisants. Autrement dit, pour des raisons de sécurité ou d'avantages en termes de performances, les propriétés d'une formulation de peroxyde organique sont généralement modifiées par l'utilisation d'additifs pour flegmatiser (désensibiliser), stabiliser ou améliorer d'une autre manière le peroxyde organique pour un usage commercial. Les formulations commerciales sont parfois constituées de mélanges de peroxydes organiques, flegmatisés ou non.

Les peroxydes sont également de puissants oxydants et réagissent facilement avec la peau, le coton et la pâte de bois[25]. Pour des raisons de sécurité, les composés peroxydiques sont stockés dans un récipient frais et opaque, car le chauffage et l'éclairage accélèrent leurs réactions chimiques. De petites quantités de peroxydes sortant des récipients de stockage ou de réaction sont neutralisées à l'aide d'agents réducteurs tels que le sulfate de fer (II). Les mesures de sécurité dans les installations industrielles produisant de grandes quantités de peroxydes sont les suivantes :
1) L'équipement est situé dans des structures en béton armé avec des fenêtres en aluminium, conçues pour relâcher la pression et ne pas se briser pas en cas d'explosion.
2) Les produits sont mis en bouteille dans de petits récipients et transférés dans un endroit froid immédiatement après la synthèse.
3) Les conteneurs sont constitués de matériaux non réactifs tels que l'acier inoxydable, certains alliages d'aluminium ou le verre foncé[26].
Pour une manipulation sûre des peroxydes organiques concentrés, un paramètre important est la température de l’échantillon, qui doit être maintenue en dessous de la température de décomposition auto-accélérée du composé[27].
Le transport de peroxydes organiques est limité. Le ministère américain des Transports répertorie les restrictions d'expédition de peroxyde organique et les matériaux interdits dans le tableau des matières dangereuses 49 CFR 172.101 en fonction de la concentration et de l'état physique du matériau :
| Nom chimique | Numéro CAS | Interdictions |
|---|---|---|
| Peroxyde d'acétylacétone | 37187-22-7 | > 9% en masse d'oxygène actif |
| Peroxyde d'acétylbenzoyle | 644-31-5 | solide, ou > 40% en solution |
| Ascaridole | 512-85-6 | (peroxyde organique) |
| Hydroperoxyde de tert -butyle | 75-91-2 | > 90% en solution (aqueuse) |
| Peroxyde de di-(1-naphtoyle) | 29903-04-6 | |
| Peroxyde de diacétyle | 110-22-5 | solide, ou > 25% en solution |
| Hydroperoxyde d'éthyle | 3031-74-1 | |
| Peroxyde de méthyléthylcétone | 1338-23-4 | > 9% en masse d'oxygène actif en solution |
| Peroxyde de méthylisobutylcétone | 37206-20-5 | > 9% en masse d'oxygène actif en solution |
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- Division de la sécurité des producteurs de peroxyde organique
- Réponses SST – peroxydes organiques
- Groupe européen de sécurité des peroxydes organiques
Notes et références[modifier | modifier le code]
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a19_199.pub2), « Peroxy Compounds, Organic »
- PATAI'S Chemistry of Functional Groups: Peroxides, Wiley, (ISBN 9780470771730)
- « Henry Rzepa's Blog: Why diphenyl peroxide does not exist. »
- Bach, Ayala et Schlegel, « A Reassessment of the Bond Dissociation Energies of Peroxides. An ab Initio Study », J. Am. Chem. Soc., vol. 118, no 50, , p. 12758–12765 (DOI 10.1021/ja961838i)
- Otto Exner, PATAI'S Chemistry of Functional Groups, Wiley, , 85–96 p. (ISBN 9780470771730, DOI 10.1002/9780470771730.ch2), « Stereochemical and conformational aspects of peroxy compounds »
- D. A. Casteel, « Peroxy Natural Products », Natural Product Reports, vol. 9, no 4, , p. 289–312 (PMID 1522977, DOI 10.1039/np9920900289)
- Rouzer et Marnett, « Mechanism of Free Radical Oxygenation of Polyunsaturated Fatty Acids by Cyclooxygenases », Chemical Reviews, vol. 103, no 6, , p. 2239–2304 (PMID 12797830, DOI 10.1021/cr000068x)
- Aldo Roda Chemiluminescence and Bioluminescence: Past, Present and Future, p. 57, Royal Society of Chemistry, 2010, (ISBN 1-84755-812-7)
- Thomas Brock, Michael Groteklaes, Peter Mischke Lehrbuch der Lacktechnologie, Vincentz Network GmbH & Co KG, 2000, (ISBN 3-87870-569-7) p. 67
- (de) « Organische Peroxide: Aufbau & Verwendung », sur StudySmarter (consulté le )
- Aubry, Pierlot, Rigaudy et Schmidt, « Reversible Binding of Oxygen to Aromatic Compounds », Accounts of Chemical Research, vol. 36, no 9, , p. 668–675 (PMID 12974650, DOI 10.1021/ar010086g)
- Heinz G. O. Becker Organikum, Wiley-VCH, 2001, (ISBN 3-527-29985-8), p. 323
- Criegee et Müller, « 1.2-Dioxan », Chemische Berichte, vol. 89, no 2, , p. 238 (DOI 10.1002/cber.19560890209)
- USCSB, « Caught in the Storm: Extreme Weather Hazards », Youtube, USCSB (consulté le )
- White NJ, « Assessment of the pharmacodynamic properties of antimalarial drugs in vivo », Antimicrob. Agents Chemother., vol. 41, no 7, , p. 1413–22 (PMID 9210658, PMCID 163932, DOI 10.1128/AAC.41.7.1413)
- « Antischistosomal efficacy of artesunate combination therapies administered as curative treatments for malaria attacks », Trans R Soc Trop Med Hyg, vol. 101, no 2, , p. 113–16 (PMID 16765398, DOI 10.1016/j.trstmh.2006.03.003, S2CID 1675813, lire en ligne)
- Zhu, Yao, Zhang et Bao, « Metal-catalyzed asymmetric reactions enabled by organic peroxides », Chemical Society Reviews, vol. 53, no 5, , p. 2326–2349 (PMID 38259195, DOI 10.1039/D3CS00735A)
- Légrádi et Légrádi, « Detection of peroxides, hydroperoxides and peracids », Microchimica Acta, vol. 58, , p. 119–122 (DOI 10.1007/BF01218105, S2CID 101877371)
- Lea, « The Effect of Light on the Oxidation of Fats », Proceedings of the Royal Society B: Biological Sciences, vol. 108, no 756, , p. 175–189 (DOI 10.1098/rspb.1931.0030, Bibcode 1931RSPSB.108..175L)
- Veibel, S. Analytik organischer Verbindungen, Akademie-Verlag, Berlin, 1960, p. 262
- Eiss et Giesecke, « Colorimetric Determination of Organic Peroxides », Analytical Chemistry, vol. 31, no 9, , p. 1558 (DOI 10.1021/ac60153a038)
- Higuchi et Zuck, « Behaviors of Several Compounds as Indicators in Lithium Aluminum Hydride Titration of Functional Groups », Journal of the American Chemical Society, vol. 73, no 6, , p. 2676 (DOI 10.1021/ja01150a073)
- Martin, « Potentiometric titration of hydroperoxide and peracid in Anhydrous Ethylenediamine », Analytical Chemistry, vol. 29, , p. 79–81 (DOI 10.1021/ac60121a022)
- « ASTM E298, Standard Test Methods for Assay of Organic Peroxides », ASTM,
- Heinz G. O. Becker Organikum, Wiley-VCH, 2001, (ISBN 3-527-29985-8) pp. 741–762
- Ozonelab Peroxide compatibility
- « Product Stewardship », American Chemistry Council, (consulté le )




![{\displaystyle A[\mathrm {O} ]_{\text{théorique}}(\%)=16{\frac {p}{m}}\times 100,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b998ff39be87af4c8016e4e2a4851a523d6f96e)