Réaction de Nierenstein
La réaction de Nierenstein est une réaction organique transformant un halogénure d'acyle (en général un chlorure d'acyle) en une halogénocétone par action du diazométhane[1]. C'est une réaction d'insertion, le groupe méthylène du diazométhane venant s'insérer dans la liaison carbone-chlore du chlorure d'acyle. Elle a été décrite pour la première fois par le biochimiste anglais Maximilian Nierenstein en 1915[2].

Mécanisme réactionnel[modifier | modifier le code]
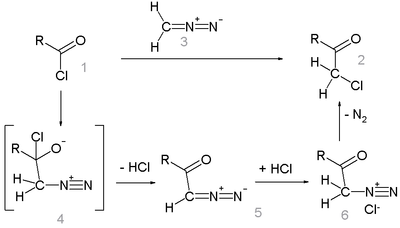
La réaction commence par une substitution nucléophile du carbone du diazométane sur le carbone du groupe chlorure d'acyle, avec dans un second temps le départ du chlore sous forme d'HCl, formant, tout comme dans la réaction d'Arndt-Eistert parente, un intermédiaire diazocétone (5). Le groupe méthylène nouvellement inséré subit ensuite une substitution nucléophile par le chlore, avec libération de diazote, formant la chlorocétone désirée (2).
Dans le cas de la synthèse de la benzylchlorométhylcétone à partir du chlorure de phénylacétyle[3], la réaction requiert l'addition de HCl gazeux à l'intermédiaire diazocétone, la réaction non assistée échouant.
Utilisation[modifier | modifier le code]
Une réaction de Nierenstein d'origine (1924)[4] :

La réaction à partir du bromure de benzoyle aboutit à la formation majoritaire d'un dimère dioxane[5] :

Notes et références[modifier | modifier le code]
- (en) W. E. Bachmann et W. S. Struve, Organic Reactions, vol. 1, New York (NY), John Wiley & Sons, , 402 p. (ISBN 978-0-471-00462-2, DOI 10.1002/0471264180.or001.02), chap. 2 (« The Arndt-Eistert Reaction »), p. 39-40.
- (en) D. Clibbens et M. Nierenstein, « The action of diazomethane on some aromatic acyl chlorides », J. Chem. Soc., vol. 107, , p. 1491-1494 (ISSN 0368-1645, DOI 10.1039/CT9150701491).
- (en) W. D. McPhee et E. Klingsberg, « Benzyl chloromethyl ketone », Org. Synth., vol. 26, , p. 13 (ISSN 0078-6209, DOI 10.15227/orgsyn.026.0013).
- (en) M. Nierenstein, D. G. Wang et al., « The Action of Diazomethane on some Aromatic Acyl Chlorides II. Synthesis of Fisetol », J. Am. Chem. Soc., vol. 46, no 11, , p. 2551–2555 (ISSN 0002-7863, DOI 10.1021/ja01676a028).
- (en) H. H. Lewis, M. Nierenstein et al., « The Action of Diazomethane on some Aromatic Acyl Chlorides III. The Mechanism of the Reaction », J. Am. Chem. Soc., vol. 47, no 6, , p. 1728–1732 (ISSN 0002-7863, DOI 10.1021/ja01683a036).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Nierenstein reaction » (voir la liste des auteurs).
