Réarrangement de Lossen
Le réarrangement de Lossen est une réaction organique permettant la conversion de l'acide hydroxamique (1) en un isocyanate (3) via la formation d'un intermédiaire d'un dérivé O (O-acylé, sulfonylé ou phosphorylé) de l'acide hydroxamique (2) et sa conversion en sa base conjuguée. Dans l'exemple ci-dessous, on utilise le chlorure de 4-toluènesulfonyle pour former un O-dérivé sulfonyle de l'acide hydroxamique[1],[2] :
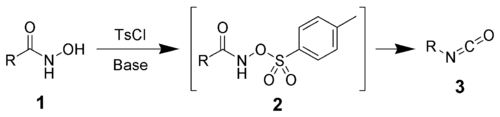
L'isocyanate peut ensuite être utilisé pour produire un carbamide en présence d'amines (4) ou produire des amines en présence d'eau (5).

Mécanisme réactionnel[modifier | modifier le code]

Le mécanisme ci-dessus débute avec un dérivé O-acylé de l'acide hydroxamique qui, traité par une base, forme un isocyanate puis est utilisé pour produire une amine et du CO2 en présence d'H2O. Le dérivé de l'acide hydroxamique est d'abord converti en sa base conjuguée par arrachage de l'un de ses atomes d'hydrogène par la base. Spontanément, un réarrangement fait partir un anion carboxylate pour produire l'isocyanate. Ce dernier en présence d'H2O s'hydrolyse et formant un dérivé carbamique. Ce dérivé perd ensuite un H+ par action d'une base, puis subit une décarboxylation pour former une amine.
Notes[modifier | modifier le code]
Plusieurs revues ont été publiées à ce sujet[3],[4],[5].
Les acides hydroxamiques sont couramment synthétisés à partir de leurs esters correspondant[6].
Références[modifier | modifier le code]
- Lossen, W. Ann. 1872, 161, 347.
- Lossen, W. Ann. 1874, 175, 271 & 313.
- Yale, H. L. Chem. Rev. 1943, 33, 209. (Review)
- Bauer, L.; Exner, O. Angew. Chem. Int. Ed. Engl. 1974, 13, 376. (Review)
- Shiori, T. Comp. Org. Syn. 1991, 6, 821-825. (Review)
- Hauser, C. R.; Renfrow, Jr., W. B. Organic Syntheses, Coll. Vol. 2, p.67 (1943); Vol. 19, p.15 (1939). (Article)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Lossen rearrangement » (voir la liste des auteurs).
