Silphium perfoliatum
Silphie perfoliée, Silphium perfolié, Silphe perfolié
avec bourgeons à gauche.

(plus de 2 mètres de haut).
Silphium perfoliatum, la Silphie perfoliée[1],[2],[3], le Silphium perfolié[4],[5] ou Silphe perfolié[5], est une espèce de plantes à fleurs herbacées, de la tribu des Heliantheae et de la famille des Astéracées. Cette vivace, diploïde (n = 7), à fleurs jaunes, haute (2,50 m et jusqu'à 2,75 m), est pérenne pour 10 à 20 ans en monocultures, et parfois bien plus en jardin. Elle est mellifère, fixe du carbone en C3.
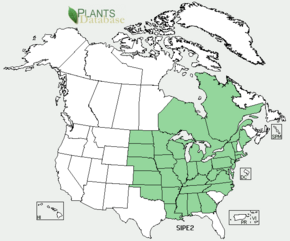
Indigène dans la moitié est de l'Amérique du Nord, mais absente du Québec et des Maritimes, elle avait des usages médicinaux chez les Amérindiens du Nord. Elle a été introduite en Europe, dans les jardins, à partir du 18e siècle (il en existe aujourd'hui plusieurs variétés ornementales). Elle a ensuite, localement, été cultivée en Russie et en Chine comme plante fourragère.
Elle a plus récemment été testée comme source de biomasse-énergie, pour produire du biométhane essentiellement, et de manière plus agro-écologique qu'avec le maïs. Elle est localement utilisée comme fourrage d'une qualité nutritive proche de la Luzerne (moins énergétique que le maïs, mais significativement riche en protéines : de 4,9 % à 15 % de la matière sèche). Elle a un potentiel de plante phytoépuratrice, et/ou pour le captage et séquestration du dioxyde de carbone via ses rhizomes. Les agriculteurs hésitent encore à planter cette cultures pérenne, car d'autres espèces produisent plus de biomasse et/ou de méthane ; elle est coûteuse dans les premières années et parfois difficile à mettre en place et moins rentable que d'autres[6].
Aux États-Unis, sur des sols ensoleillé mais frais, légèrement humide en été la silphie perfoliée peut être localement très envahissante. Là, sa productivité et sa taille (jusqu'à 2,75 m, produisant jusqu'à 1,5 kg de matière sèche par plant et jusqu'à 350 capitules par plante dès la seconde saison de croissance) en ont fait une candidate pour de nouvelles cultures énergétiques, mais cette possibilité est très discutée en raison de coûts d'installation élevés ; de son potentiel invasif (qui s'exprime y compris dans son aire naturelle de répartition) ; et d'une sensibilité à quelques déprédateurs autochtone, en particulier à un insecte (nord américain) qui peut en ravager les monocultures : l' Eucosme géant.
Description[modifier | modifier le code]


Taille de 90 cm à 2,75 m, fleur de 5 à 10 cm de diamètre. Capitules jaunes à disques plat entouré de ligules pétaloïdes, en bouquets lâches, au sommet d'une tige quadrangulaire; feuilles opposées, ovales, dentées, celles du haut engainant la tige. Son nom anglais (cup plant) évoque la « coupelle végétale » formées par les feuilles soudées autour de la tige, qui recueille de l'eau météoritique ou de rosée ou condensation du brouillard contre la tige[7]. La floraison est étalée de juillet à septembre au Québec.
La plante présente des formes et tailles et comportements assez variés selon ses « accessions » (mot désignant en biologie une souche d'une espèce qui a été collectée dans un lieu spécifique et à un moment spécifique[8].
Composition (matière sèche) : elle varie selon les souches et le contexte cultural et météorologique, avec : 16 à 28% de protéines, plus de 60% de matières non azotées, 13 à 23 % de sucres, beaucoup de minéraux, un peu de fibres (beaucoup en fin de saison) et source variable, modérée à importante, de calcium et de phosphore, de carotène et de vitamine C [9]. À titre d'exemple : Shalyuta et Kostitskaya (2018) donnent : calcium (18,1 mg par kg), phosphore (2,55 mg par kg), manganèse (4,48 mg par kg), potassium (24,03 mg par kg), sodium (0,40 mg par kg) de soufre (0,40 mg par kg) avec 17,6% de matière sèche[9]. Elle est à peu près aussi nutritive pour les animaux que la luzerne[10].




Habitat naturel[modifier | modifier le code]
Seleon l'USDA[11], la Silphie perfoliée se rencontrait surtout sur les terrains bas, dans les zones humides, le long des ruisseaux des prairies, des fourrés alluviaux, des plaines inondables et le long des lisières des forêts humides. Cette espèce était commune dans la grande prairie nord américaine, dite Prairie d'herbes hautes, mais plus sporadiquement vers le nord selon Ladd (1995)[12],[13] Aujourd'hui, cette région est grandement réduite en raison de l'agriculture et de l'urbanisation, mais les reliques de la Grande prairie restent importantes pour la biodiversité, servant d'habitat à diverses espèces de plantes et d'animaux. Le Silphium perfoliatum autochtone vit aux latitudes tempérées de l'Amérique du Nord (Nord-Est des États-Unis et Sud-Est du Canada) dans des habitats plutôt ensoleillés et caractérisés par un air humide et un sol humide, profond et riche (glaiseux, sableux ou limoneux), pas trop acide, typiquement dans les vallées alluviales plutôt naturellement eutrophes, sur les berges de cours d'eau ou de lacs, et parfois sur les pentes ou fonds de ravins (Sokolov et Gritsak, 1972, Vacek et Řepka, 1992), ou encore dans les zones humides sablonneuses proches de la nappe, ou dans certaines plaines inondables près du lit de cours d'eau (Stanford, 1990), dans les prairies humides, dans les forêts ouvertes ou à leur proximité (Huxley et al., 1992 ; Kowalski et Kędzia, 2007). Son rhizome tolère le gel (jusqu'à −40 °C pour une variété commercialisée), et la plante supporte quelques semaines de sécheresse[14]. C'est une plante essentiellement pérenne dont le rhizome vit au moins 15 ans (on en trouve des spécimens de plus de 50 ans dans certains jardins)[15].
Certaines de ses populations sauvages originelles sont menacées ou ont disparu, dont dans les prairies naturelles dégradées par le drainage, les incendies et la fragmentation écopaysagère. Ainsi, dans 54 vestiges de prairies suivies dans le Wisconsin par des études botaniques : 8 à 60 % des plantes autochtones ont disparu en 32 à 52 ans, notamment celles qui avaient besoin d'incendies périodiques, et celles qui sont vulnérables à la fragmentation écologique[16].
Écologie et agroécologie[modifier | modifier le code]
Dans son environnement d'origine, où l'espèce a longuement co-évolué avec ses déprédateurs et leurs ennemis locaux, la Sylphie a les caractéristiques d'une espèce clé de voûte, source de services écosystémiques précieux[17].
Sa longue floraison et l'abondance de ses fleurs mellifères en font une source de nectar intéressante pour les abeilles domestiques ou sauvages. Elle nourrit plusieurs pollinisateurs indigènes nord-américains importants : plus de 12 espèces d'abeilles, de mouches et de coléoptères indigènes sont fréquemment retrouvés dans les cultures de Silphium perfoliatum, et bien plus sur les populations vivant encore en milieu naturel[18].
Là, selon Julianna Tuell et al. en 2008, c'est la fleur la plus attractive pour le bourdon Bombus impatiens, et elle attire plus d'individus que d'autres plantes à fleurs. « Un très large éventail d'espèces d'insectes visitant ces fleurs »[19]. Ainsi, dans des restes de prairies sauvages étudiés dans l'Iowa où elles persistent localement sous forme de quelques « taches » dans le paysage, et sous forme de longues bandes linéaires plus ou moins épargnées le long d'axes de transport, la Silphie est considérée comme « plante à abeilles et à papillons » (et Davis et al., en 2008, notaient, sans pourvoir à ce jour l'expliquer, que pour les 20 zones reliques qu'ils ont étudié : ces plantes attiraient soient des abeilles, soit des papillons, mais jamais les deux ; un phénomène qu'il serait intéressant de comprendre pour à la fois mieux protéger les abeille et les papillons)[20]. Pour cette raison, dans un contexte de grave déclin de la diversité des pollinisateurs[21] et de leurs services écosystémiques[22], là où l'espèce ne risque pas de devenir envahissante, il été recommandée aux États-Unis d'en planter ou d'en laisser s'épanouir en lisière de champs pour attirer les abeilles pollinisatrices (Decourtye et al. 2010)[23]. Dans le cas où les champs voisins ne sont pas conduits en agriculture biologique, les buissons de Silphie peuvent cependant, comme pour le Buddleia, possiblement devenir des puits écologiques dangereux pour les populations locales d'insectes.
Fiedler et Landis (2007) ont aussi montré que les massifs de silphies sont — aux États-Unis — très attractifs pour divers arthropodes herbivores locaux. Ces derniers sont potentiellement déprédateurs, ils sont là contrôlées par un nombre encore plus élevé de leurs adversaires naturels. Selon ces auteurs, la Sylphie est même, là bas, la plante qui attire le plus de prédateurs ou parasites d'organismes déprédateurs autochtones[19].
Par contre, en Europe, et même en Allemagne, où l'espèces est cultivée depuis près de 20 ans, l'attrait de la Silphie pour les insectes dits nuisibles (pour l'agriculture) et/ou pour leurs prédateurs n'est pas encore prouvé.
Comme le Cabaret des oiseaux, le long de la tige les feuilles opposées sont soudées et forment de petits bassins retenant l'eau de pluie ou un peu de rosée ; une source d'eau utile à diverses espèces et qui contribue à entretenir une hygrométrie élevée dans les touffes de plantes. Dans l'aire naturelle de répartition de l'espèce, certains déprédateurs (hyménoptère, coléoptère… voir exemple plus bas) contribuent naturellement à en limiter le caractère envahissant[18].
Les touffes denses de Silphie perfoliée peuvent d'abriter une petite faune de vertébrés et d'invertébrés qui peine à trouver des habitats sûrs en milieu rural (petit gibier y compris), mais dans les monocultures 100 % du champ est généralement coupé, en fin de printemps puis en début d'automne, sans zone-refuge pour les animaux qui se trouvent alors vulnérables, brusquement exposés aux éléments et aux prédateurs, s'ils n'ont pas été tués ou blessés par les engins de récolte au moment de la coupe et de l'ensilage.
Un bilan agroécologique (agrobiodiversité aérienne et souterraine) des cultures mixtes de Silphie (Silphium perfoliatum L.) a été fait en Allemagne, car certaines analyses et modélisations[24] la font considérer comme, potentiellement, l'une des futures ressources pour la biométhanisation, mais on attend aussi de forte perturbation des régimes hydriques et, en 2007, l'Institut international de l'eau de Stockholm a alerté[25] sur les pénuries massives d'eau induites par les cultures énergétiques, de type maïs notamment[26]. Des essais d'irrigation en goutte à goutte ont été faits en Pologne, montrant (2015) un gain de hauteur (+ 53% en moyenne par rapport à une parcelle non irriguée), du à un accroissement (+ 37%) de la longueur de l'entre-noeuds et un gain en poids et en nombre de feuilles, ainsi qu'un gain en diamètre de tige (doublement)[27]. Les feuilles peuvent atteindre 40 cm long et 25 cm de large[11].
Le taux de réussite des semis agricole est très variable ; des essais de duplication par clonage in vitro ont été faits.
Répartition[modifier | modifier le code]
Cette espèce est native de la moitié Est de l'Amérique du Nord (elle a le statut de plante invasive dans plusieurs États aux États-Unis)[28],[29],[30].
Elle a été introduite en Europe comme plante étonnante par sa taille, ou décorative, au 18e siècle[31]. Une étude sur les plantes exotiques réalisée en Italie en 2009 l'a classé parmi les taxons occasionnels[32] et neuf ans plus tard comme « néophyte naturalisé »[33].
Puis, plus récemment, d'abord en Russie et Europe de l'Est, et en Chine, elle a été plantée comme plante fourragère. En Chine, selon Feng et al. en 2013, sa culture avait déjà été testée ou pratiquée dans chacune des provinces chinoises[34].
Taxinomie[modifier | modifier le code]
L'espèce a été formellement décrite en 1759 par le naturaliste suédois Carl von Linné, dans son ouvrage Systema naturae.
Deux variétés sont reconnues par la Global Compositae Database (22 avril 2024)[35] :
- Silphium perfoliatum var. connatum (L.) Cronquist (synonymes : Silphium connatum L., Silphium perfoliatum subsp. connatum (L.) Cruden et Silphium scabrum Moench)
- Silphium perfoliatum var. perfoliatum L.
Domestication, culture[modifier | modifier le code]
Historique[modifier | modifier le code]
Bien qu'introduite plus tôt, sa culture semble n'avoir débuté que dans les années 1950, en Russie, comme plante d'ensilage pour l'élevage[31].
Au moins 5 cultivars sont aujourd'hui mis sur le marché pour l'agriculture, dits Russie, Ukraine, Amérique du Nord, Allemagne et France. Le mode de récolte/ensilage est actuellement similaire à celui du maïs.
De 1974 à 1981, en France, L'INRA a étudié la productivité et quelques aspects d'intérêt alimentaire de cette plante. Mais elle était alors économiquement moins intéressante que la culture agroindustrielle de maïs d'ensilage qui commençait à se développer.
Dans les années 2010 et 2020, elle suscite - ainsi qu'une espèce voisine (Silphium integrifolium Michx.)[8] - un regain d'intérêt (tout comme la Mauve de Virginie, Sida hermaphrodita, avec laquelle elle et souvent comparée) en raison de son intérêt pour la méthanisation, et de sa rusticité, se sa tolérance aux sols mal drainés et/ou inondés au printemps, alors que le maïs doit faire face à des manques d'eau, au développement de résistance au pesticides chez certains insectes déprédateurs et chez certaines mauvaises herbes » concurrentes[31] et pour d'éventuels autres usages[36]. Sur la base d'expérimentations, le Julius Kühn-Institut (Centre fédéral allemand de recherche sur les plantes cultivées) concluait cependant (en 2016) qu'en termes d'efficacité d'utilisation de l'eau, cette plante est aussi efficace que la luzerne, mais nettement moins que le maïs[7]. Alors que les feuilles bases du maïs restent photosynthétiquement actives jusqu'à la récolte, celles de la Sylphie tendent à mourir prématurément (ce qui peut être problématique pour une utilisation en fourrage animal), privées de lumière en raison de l'indice élevé de surface foliaire et de la densité du feuillage[7]. Normalement, les pousses secondaires n'apparaissent qu'en deuxième année, mais avec un semis précoce au au printemps et une pré-culture en serre et en condition optimales, puis plantation dans les meilleures conditions, la plante peut produire des pousses secondaires dès la première année[7].
En agriculture, cette plante - si elle ne développe pas de nouvelles tendances à l'invasivité - grâce à « son apport de grandes quantités de matière organique ainsi que le verdissement à long terme » peut contribuer à l'agrodiversité et à la protection des sols et de l'eau[7], mais selon Schoo et ses collaborateurs (2017), l'eau reste un facteur limitant si l'on souhaite une productivité s'approchant de celle du maïs « des rendements en matière sèche de la Silphie perfoliée aussi élevés que ceux du maïs ne pourront être atteints que sur des sites bien approvisionnés en eau, que ce soit grâce à une grande réserve d'eau dans le sol, à un raccordement à la nappe phréatique, à de fortes précipitations ou à une irrigation supplémentaire »[37].
La date de récolte est à choisir selon l'usage souhaité. Par exemple une fauche précoce (22 août)[38] permet une production plus élevée de glucides, de graisses et de protéines rapidement convertibles, alors qu'en fin de saison de croissance, la plante sera plus riche en fibres (avec des teneurs en cendres qui augmentent)[39],[40],[8].
Expérimentation[modifier | modifier le code]
Des monocultures de Silphie, récoltée à la manière du maïs et parfois associée à du maïs ou du blé ou du seigle la première année, sont testées depuis quelques décennies dans le monde : localement en Amérique du Nord, en Amérique du sud (dans les zones tempérées du sud du Chili)[41] et en Europe[42], dont en Allemagne (environ 400 ha en Allemagne vers 2015)[7], puis en France où elle était testée comme nouveau fourage au début des années 1980[43], puis comme culture énergétique, notamment en Nouvelle Aquitaine[31] et dans les départements de la Loire et du Rhône, y compris dans un but d'agriculture de conservation, et par agriculteurs possédant une unité de méthanisation[14].
Les principaux usages sont :
- produire un nouveau fourrage d'ensilage[44],[45] de complément pour l'alimentation animale[46] : la silphie, présente une valeur protéique intéressante pour complémenter la ration (de 4,9 % à 15 % de la matière sèche[47], soit un taux supérieure à celui mesuré dans le maïs fourrager), mais avec un moindre apport en amidon (énergie). La silphie est comparable à un sorgho, mais en plus protéique selon Amédée Perrein (qui commercialise les semences de silphie destinée à l'agriculture)[14]. Plusieurs variétés, sélectionnées pour leur productivité en biomasse, sont testées et utilisées comme "nouveau fourrage"[48]. Elle peut être pâturée in situ, ou utilisée en ensilage ou en enrubannage[31].
- produire des tiges ligno-cellulosiques sèches, déjà « largement utilisées comme combustible solide en Pologne »[49].
- produire de la biomasse à méthaniser, soit directement, soit après une utilisation en plante séchée, comme paillage sous les animaux en stabulation, pour d'autres usages de paillage, et commencent à être exploitées comme culture énergétique, en Allemagne (essentiellement depuis le début des années 2000) et Pologne[50] et ailleurs en Europe centrale. Comme le miscanthus, le switchgrass, la canne de Provence, cette plante a un potentiel méthanogène intéressant (300 voire 350 litres de gaz par kg de matière sèche (MS), soit en moyenne 4 000 m³ à 4 500 m³ de gaz/ ha selon un promoteur de cette culture en France, en 2021)[14]. Selon Gansberger en 2015, le rendement annuel en matière sèche est d'environ 15 t/ha (avec des records aux environ de 25 t/ha)[8], et le potentiel de biométhane (en 35 jours) est d'environ 0,260 m3/Kg sur la base de la matière sèche organique (soit 20 % de moins que pour le maïs ensilé)[51]. En Pologne, Stolarski et al. (2022) ont obtenu leur meilleur rendement en biomasse (16,3 Mg ha−1 y−1 MS) à la 5e année culturale et après une fertilisation minérale à raison de 170 kg ha−1 N. Ce rendement est près du triple de celui obtenu sur des parcelles-témoin non fertilisées[52].
Selon une étude plus récente, le rendement moyen en France serait plutôt de 13 tonnes de MS/ha, et son pouvoir méthanogène pourrait atteindre 300 m3 CH4/t MS, environ 15% inférieur à celui du maïs[31].
La Silphie perfoliée a donc un pouvoir méthanogène assez proche de celui du maïs (20 % de méthane en moins selon Gansberger en 2015[51], 15 % selon une étude plus récente en Nouvelle Aquitaine). Sa pérennité une fois bien installée renforce son intérêt agro-énergétique, d'autant qu'on lui reconnait aussi un intérêt agro-écologique[51] (voir plus bas).
Pour rappel, en, France, pour éviter les dérives constatées dans d'autres pays (Allemagne notamment) en terme de détournement vers la méthanisation de volumes d'intérêt alimentaire, et en terme de facteurs de pression en faveur de changement d'usage des sols, les plantes pérennes sont classées dans la catégorie des « cultures principales », et elles sont plafonnées par la loi à 15 % dans les méthaniseurs[14].
Deux récoltes sont possibles dans l'année. Une double récolte permet à l'agriculteur de « sécuriser le stock alimentaire avant les grosses chaleurs »[14] - mais alors en perdant l'intérêt mellifère et de zone-refuge du champ - de la plante car la 1ère coupe est faite au stade bouton (quand la plante a la meilleure valeur nutritive) ou au moment des premières fleurs (vers le 15 juin)[14], c'est à dire en fin de période de reproduction et en période d'élevage des jeunes. La seconde coupe se fait vers le 15 septembre[14], ce qui prive à nouveau les petits animaux d'abris en saison de chasse et avant l'hiver. Cette culture est encore relativement confidentielle en France, mais elle est testée à un peu plus grande échelle depuis 2018.
Cependant, tant que le champ n'est pas solidement établies, la culture peut nécessiter un soin attentif, en tenant compte de la biodiversité et de solutions proches de la natue pour faire face au dérèglement climatique[6]. Le stade du semi est particulièrement délicat en raison d'une levée souvent difficile et hétérogène ou, la première année, les plants sont facilement concurrencés par des adventices (ex. : renouée persicaire, poacées et Panicum sp., renouée liseron, renouée des oiseaux, Rumex, Chardons, mourons, potentilles…). Pour espérer bien démarrer une monoculture, le sol doit être profond et légèrement humide au moment du semi avec un pH pas trop bas (c'est à dire pas trop acide) et la graine semée dans les 1,5 premiers centimètres d'un sol sol légèrement humide et à une température idéale de 14 °C ; avec de 3,6 à 4 kg de graines par hectare, soit environ 220 000 graines/ha[53]. Les essais faits en Aquitaine se sont faits avec 2 à 3 kg de graines par hectare (3 kg = environ 150 000 graines/ha, pouvant donner en cas de très bonne levée 120 000 pieds/ha)[53]; ils ont montré que la levée se fait souvent mal (et pas du tout si la graine est enfouie à plus de 2 cm). Dans cette région globalement dans 1/3 des cas ou des surfaces le semis était un succès, dans un 13 des cas, il était mitigé et dans 1/3 des cas, il a échoué ; un roulage avant semis, pour optimiser la profondeur de semis, puis un roulage post-semis sont « fortement conseillé afin d'optimiser la levée »[53]. Dans les jardins ou petites parcelles expérimentales, on peut aussi utiliser un fragment de rhizome pour dupliquer la plante, mais on se prive alors de la diversité génétique permise par la reproduction sexuée[52].
Au vu des retours d'expérience, cette étude recommande ensuite des apports d'engrais NPK chaque année.
| Elément minéral | N | P | K |
|---|---|---|---|
| Lors du semis | 45 | 45 | 45 |
| 2ème année | 140 à 200 | 80 à 100 | 170 à 200 |
| 3ème année et suivantes | 100 à 150 | 50 à 70 | 100 à 150 |
Incertitudes[modifier | modifier le code]
En Amérique du Nord, les rendements de monocultures attaquées par les chenilles de l' Eucosme géant peuvent être divisée par deux. En Europe, la Silphie perfoliée semble - à ce jour - avoir peu de déprédateurs, mais on observe néanmoins des variations importantes de rendement en fonction du sol, des années (ensoleillement, pluviométrie..) et du type de fertilisation et du taux d'azote apporté[52].
Si l'objectif est de produire de l'électricité à partir du biogaz, des rendements élevés sont nécessaires au champs et dans le méthaniseur. Selon Stolarski (2022), la fertilisation de la culture de Silphium augmente le taux de matière sèche, mais n'a « pas d'impact significatif sur l'efficacité du biogaz ou du méthane ». L'efficacité de biogaz la plus élevée pour la biomasse de S. perfoliatum est de 372,8 m3 Mg−1 DM, avec un revenu de vente d'électricité deux fois plus élevé qu'à partir d'une méthanisation de Helianthus salicifolius[52].
Coûts[modifier | modifier le code]
Selon une revue d'études (2015) faites par deux universitaires autrichiens du domaine des agrobiotechnologies, avec l'Agence autrichienne pour la santé et la sécurité alimentaire, sur ce potentiel pour la biométhanisation : « la production de silphium au cours de la première année demande beaucoup de travail et de frais (à ce jour, l'établissement des cultures est plus efficace si fait à partir de plants plutôt que semé directement, en raison de la mauvaise qualité des semences et du manque de technologie des semences. Les mesures de lutte contre les mauvaises herbes sont élevées l'année de l'établissement) » (Il faut 5 ans pour amortir les coûts initiaux de plantation)[54],[55]. Selon un vendeur français de semences de silphie perfoliée, il faut compter environ 2 000 euros/hectare (1 700 € de semences, 60 € d'engrais starter, 60 € de désherbants, 100 € pour une ETA)[14]. Mais ensuite « les besoins en entretien et les coûts de production sont faibles. Le silphium peut rivaliser avec d'autres cultures énergétiques en ce qui concerne le rendement en matière sèche »[51].
Intérêts agroenvironnementaux connexes[modifier | modifier le code]
La culture de la Silphie perfoliée, sous réserve que l'espèce ne devienne pas invasive, a divers intérêts pour le sol, à commencer par son effet "couvre-sol", qui par rapport au maïs ou à d'autres cultures protège le sol de l'érosion et du tassement[51]. En particulier, sur les pentes, cette culture n'a pas les inconvénients du maïs, souvent cultivé avec des pesticides et engrais, et qui est en hiver source d'érosion des sols et d'eutrophisation en aval[56].
En outre, par rapport au maïs conventionnel notamment, elle ne crée par de semelle de labour (et ses racines descendent plus profondément, jusqu'à près de 3m si le sol le permet et dans les meilleures conditions) ; elle peut contribuer à réduire les pollutions de nappe ou de surface par lixiviation et transferts verticaux ou horizontaux de nitrates, tout en diminuant le risque d'érosion et de dégradation des sols[31].
Litière et apport en carbone et azote pour le sol[modifier | modifier le code]
La Silphie pérenne produit plus de produits rémanents laissés sur le sol après récolte (deux fois plus environ) que le maïs, mais comme pour le maïs, un léger déclin apparait au fur et à mesure des années ; cette litière contient en moyenne 8 à 35 % plus de Carbone total que la litière de maïs, elle est parfois plus riche en azote total que la litière du maïs, mais pas toujours, le rapport C/N varie selon les années[6]. Et plus il y a d'azote (N) dans la litière, plus il y a de vers de terre sous la culture[6].
Les feuilles de maïs sont nettement plus riches en fibres que celles de la Silphie perfoliée et les résidus de la Silphies ont un ratio moyen C/N plus élevé que celui des rémanents de maïs[6].
Microfaune du sol[modifier | modifier le code]
Le réseau racinaire dense et développé de la Silphie perfoliée, et son caractère pérenne font qu'il peut produire plus d'exsudats racinaires, et donc être une source plus constante et intéressante de nourriture pour la microfaune, la microfonge et pour tout le réseau trophique du sol[57],en raison de l'abondance et de la diversité des sources de nourriture (Eisenhauer et al., 2013).du sol[58],[51],[59],[60]. Selon Chen et ses collègues en 2014 : ces sources de nourriture de haute qualité, et le type de fertilisant utilisé (engrais organique vs engrais chimique) peuvent aussi favoriser la biodégradation de la matière organique plus récalcitrante[61]. Ces conditions favorisent la résilience face aux petites périodes de sécheresses et aux inondations
Les vers de terre[modifier | modifier le code]
Il sont les organismes du sol les plus étudiés sous les cultures de Silphies. Leur quantité varie selon la saison et le contexte (il faut des années pour que les gros vers de terre arrivent et trop de sécheresse ou des inondations trop fréquentes ou longues peuvent retarder l’arrivée de ces gros vers de terre importants pour la vie du sol). De manière générale, ces organismes fouisseurs qui sont considérés comme très utiles et de bons bioindicateurs, sont nettement moins rares dans les culture de Silphium perfoliatum que sous le maïs conventionnel (non-biologique), probablement en raison de l'absence de labour et de travail du sol et grâce à la formation d'une litière de matière organiques un peu plus nutritive pour la faune du sol (pédofaune) que sous le maïs. La structure de la communauté des vers de terre dans les champs de Silphie perfoliée est globalement similaire à celle du maïs, mais avec une proportion significativement plus élevée de juvéniles[6].
Par exemple, lors des relevés faits in situ par Lena Wöhl (« Insitut Thünen de la Biodiversité » à Braunschweig en Allemagne) et ses collègues en 2024; « le nombre de vers de terre individuels par m2 dans les champs de Silphie était de 29,5 % à 189,9 % plus élevé que dans les champs de maïs »[6]. Néanmoins, diverses études ont montré que la mise en place d'une population de vers riche et diversifiée est lente [6] (au moins une décennie)[26].
Wöhl et ses collègues, en 2024, notaient que sous le maïs, le nombre de vers de terre est beaucoup plus élevé s'il y a eu antérieurement une rotation de culture, auvec une phase prairiale. Ils notent aussi que « l'abondance des vers de terre était positivement corrélée avec les précipitations cumulées dans les 3 mois précédant l'échantillonnage », ce qui n'était pas le cas sous les monocultures de silphies où « la biomasse des vers de terre est négativement corrélée à la densité apparente de la couche arable du sol ». Et sous ces cultures, les vers de terre sont beaucoup plus gros que sous le maïs (jusqu'à 4 fois plus de biomasse dans les inventaires de Wöhl publiés en 2024), tout en sachant que le type d'engrais affecte la biomasse en vers de terre, une fumure organique de type fumier ou lisier les favorisant beaucoup par rapport aux engrais chimiques/minéraux)[6].
En Allemagne, comme sous d'autres cultures pérennes, on a observés sous les plantations pérennes de Silphies perfoliées une diversification d'espèces de vers de terre ( Lumbricus terrestris, Lumbricus castaneus, Lumbricus rubellus, Aporrectodea caliginosa, Aporrectodea rosea, Aporrectodea longa, Allolobophora chlorotica,Octolasion cyaneum, Octolasion lacteum) et parmi ces 9 espèces, 4 espèces n'apparaissent qu'au fur et à mesure du vieillissement de la parcelle[26]. Alors qu'il y avait dans les parcelles jeunes peu de vers de terre (comme sous le maïs : biomasse de 30 ± 8 g/m² avec une cinquantaine de vers par m2), le nombre de vers de terre augmente ensuite (51 individus par m²), ainsi que leur biomasse (passée de 93 à 352 g par m2 sur certaines parcelles, soit + 324%). La diversité des vers de terre progresse avec les ans : un Octolasion n'est apparu qu'après 3 ans pour se faire ensuite plus commun, puis une nouvelle espèce de lombric est apparu après 5 ans, et il continuait à augmenter sa population 8 ans après. Cependant la variété des espèces reste inférieure à celle d'une prairie naturelle. Dans les parcelles suivies en Allemagne, globalement durant les 9 premières années, la biomasse et l'activité des vers de terre augmentait à un rythme proche de celui de la diversification en espèce[26].
Collemboles, nématodes[modifier | modifier le code]
Des évolutions similaires sont constatées pour les collemboles, mais si la biomasse de nématodes se développe bien, sans aucun travail du sol, avec une croissance de la communauté des nématodes fongivores montrant que le canal de la décomposition fongique croît. Cependant dans les 9 premières années après la plantation, les chercheurs n'observaient toujours pas de diversification, ce qui fait conclure au bilan agroécologique de 2016 : qu'« il est clair que les silphias restent des communautés arables typiques même après 8 ans »[26].
Pollinisateurs[modifier | modifier le code]
La longue période de floraison de cette plante mellifère, et l'effet « couvre-sol » de ses cultures ont aussi un intérêt agroécologique ; pour les pollinisateurs, et contre l'érosion des sols[51]. Certains bourdons (dont les ruches sont enfouies dans le sol) apprécient les fleurs de la silphie perfoliée.
Effets sur l'infiltration d'eau dans le sol[modifier | modifier le code]
selon Wöhl et al. (2024), en saison de végétation, quand l'eau tombe sur un champ de maïs, elle pénètre dans le sol 47% plus vite que sur une monoculture de Silphie (avec des variations selon les années (par exemple, en 2020, l'eau s'infiltrait 35% plus vite dans les champs de Silphie et 67% plus vite dans les champs de maïs, surtout quand il pleuvait beaucoup)[6]. Dans tous les cas, ni le nombre de vers de terre dans le sol, ni leur biomasse, n'expliquait les différences et variations observées en saison de végétation dans la vitesse d'infiltration de l'eau dans le sol ; que ce soit pour les vers de terre vivant en surface ou pour ceux vivant en profondeur. Enfin, l'histoire des usages antérieurs du sol ne semblait pas non plus pouvoir expliquer ces différences[6].
Risques phytosanitaires et/ou d'invasivité[modifier | modifier le code]

Papillon naturellement associé à la Silphie dans l'aire naturelle de répartition de cette plante (moitié Est des États-Unis). Il est devenu le principal déprédateur des monocultures de silphies dans ce pays, où il cause des pertes de rendement dépassant souvent les 50 %.

En 2019, des agronomes et experts en insectes déprédateurs du « Insect Biodiversity Lab » de l'Université d'État du Dakota du Sud estiment qu'à ce jour, « tous les déprédateurs sérieux connus de la plante ne sont connus qu'en Amérique du Nord »[62]. Là, dans son aire naturelle de répartition, S.perfoliatum est notamment contrôlée par quelques espèces d'insectes qui deviennent ravageurs dans ses monocultures, étudiés et suivis depuis 2004 dans le Dakota du Sud et le Wisconsin, avec notamment :
- L'Eucosme géant (Eucosma giganteana) est le plus spectaculaire en termes de dégâts : aux États-Unis, dans les cultures de Silphium perfoliatum les larves de cet insecte affectent considérablement la croissance de la plante[63],[64]. Sa larve est la principale cause connue des dommages dans les cultures de Silphie perfoliée en Amérique[18]. On en retrouve dans toutes les situations (agronomiques et sauvages)[18]. S'il a toujours une incidence minime sur les populations sauvages, où l'on note que les plantes « attaquées » par la chenilles se remettent nettement mieux dans les sites semi-humides que dans les sites secs[18], quand il pullule, il peut rapidement et complètement stopper la croissance de la tige, des pousses et des inflorescences[62].
Au début des années 2000 dans le Dakota du Sud et le Wisconsin, toutes les cultures âgées de deux ans ou plus étaient infestées ; le maximum des dégâts visibles est atteint en début d'été, dus aux chenilles qui, aux trois premiers stades larvaires mangent les méristèmes apicaux (y compris ceux des bourgeons floraux). On trouve alors généralement 35 à 60 chenilles par méristème, qui tuent généralement l'apex, ce qui bloque la croissance en hauteur de la tige ; 100 % des fleurs sont perdues dans les peuplements touchés, entre fin juin et fin juillet. Dans ces cas, l'intérêt apicole est nul et la production de biomasse et divisée par deux. Certaines tiges produisent néanmoins en aout des inflorescences (latérales), mais qui n'arriveront à maturité que chez 5 à 10 % des plantes (voire jamais dans les sites secs, dits xériques, alors que dans les sites encore modérément humide, dits mésiques, la plante produira de nombreuses excroissances latérales compensant la tête de la plante endommagée[18].
Fin juillet-début août, la chenille quitte le haut de la plante où elle s'est alimentée pour descendre le long de la tige. Là elle s'enterre, à moins de 1,5 cm de profondeur, au niveau du rhizome où elle passera l'hiver en s'en nourrissant. C'est au début du printemps suivant, qu'elle se construira un cocon dans le rhizome, qui donnera naissance à un imago plutôt dans la seconde quinzaine de juin.
Cet insecte n'avait pas de parasites connus (en 2012), mais on observait un taux de mortalité des larves très important (≥98 % par plante)[18]. Selon Jhonson (2012), « les conditions agronomiques de monoculture entraîneront une perte de près de 100 % des récoltes de semences, et une perte de 50 à 60 % de la biomasse récoltée »[18].
Un examen du taux d'infestation des rhizomes par ces larves a révélé des variations significatives selon le lieu et selon les groupes génétiques étudiés, variations encore à expliquer[62]. Un parasitoïde de ces larves a été découvert, mais uniquement dans les méristèmes floraux (pas dans les larves de la couronne ni dans celles des rhizomes)[62]. - Dans les mêmes régions (Dakota du Sud, Wisconsinn) vit aussi un insecte cynips producteur de galles (du genre Antistrophus), qui se nourrit de la moelle de la tige de Silphium perfoliatum ; il peut être parasitées par plusieurs espèces de guêpes parasitoïdes du genre Tetrastichus, dans une proportion encore mal évaluée.
- Un coléoptère du genre Mordelistena (Mordelistena aethiops), de la famille des Mordellidae, qui semble plutôt commun dans le sud du Wisconsin, et qui creuse des tunnels dans la moelle de la tige, où il peut être à l'origine d'une pourriture du pied[18].
Aux États-Unis ont aussi été signalés des dommages par des rouilles qui attaquent les tiges et des feuilles (Puccinia silphii) ; ainsi que par des arthropodes phytophages (pucerons, pyrales). On observe aussi des dégâts légers faits par le dindon sauvage (Meleagris gallopavo L.) ; ou encore par le cerf de Virginie (Odocoileus virginianus), chaque année en début de saison[65].
Lors d'une étude (2008) faite à l'Université des sciences de la vie de Poznań, cette espèce (usage décoratif urbain) a été retrouvée infestées de pucerons (Aphis fabae')[66].
Les auteurs du bilan agroécologique allemand de 2016 (Chap. 1.1.2.6, p. 59) attirent l'attention sur les densités de population « extrêmement accrues » d'espèces d'Helicotylenchus, curieusement sans pertes évidentes de rendement, alors que ces nématodes sont plutôt connus comme phytoparasites déprédateurs. De même, ils jugent « également frappant de constater que les espèces de la famille des ravageurs Pratylenchidae n'apparaissent que dans les cultures de maïs »[26].
On sait que tous les ravageurs sont favorisés par les monocultures. Boe en 2019 a montré aux États-Unis qu'en mélangeant plusieurs des espèces (dont la Silphie) cibles de ces ravageurs dans une même culture, chacune est moins attaquée par ces déprédateurs grâce à un taux d'infestation réduit pour chaque espèce. Et dans ce contexte, les abeilles pollinisatrices indigènes disposeraient en outre de plus de ressources florales (et extra-florale) ; et le milieu abrite alors globalement plus d'auxiliaires des cultures (prédateurs, et hyperparasites qui parasitent des espèces nuisibles pour l'agriculture). Les retours d'expériences soutiennent l'hypothèse des modèles de stabilité des communautés écologiques où des combinaisons complexes de plantes abritent une plus grande diversité d'insectes et une perte proportionnellement réduite de biomasse végétale, par rapport aux monocultures[63]. Les auteurs « prédisent que les plantations multi-espèces destinées à la production de bioénergie pourraient être relativement exemptes de pesticides et gestion intensive »[63].
Selon une première étude faite dans les années 2010 en Allemagne sur des cultures testées sur les rives du Danube, cette espèce ne semblait pas encore, dans ce contexte, être hôte d'insectes dits ravageurs, ce qui laisse supposer qu'elle ne contribuera pas à la diffusion de maladies fongiques et virales aux cultures céréalières environnantes[67]. Or chez une espèce à forte croissance, produisant beaucoup de graines, résistante aux inondatins, ce manque de prédateurs peut contribuer au risque d'invasivité.
Indices d'invasivité[modifier | modifier le code]

La législation européenne classe comme invasive toute espèce dont a propagation menace la biodiversité[69]. Concernant Silphium perfoliatum, « Son statut exotique, sa productivité élevée et son potentiel de reproduction élevé, pourraient entraîner le risque que cette espèce devienne envahissante »[68].
La Base d'information sur les espèces exotiques envahissantes et le Centre de ressources Espèces exotiques envahissantes de l'UICN-France et de l'Office français de la biodiversité (état 2021) rappellent qu'en Nouvelle Angleterre (USA) où elle est autochtone, cette espèce est inscrite dans la liste des espèces présentant un risque élevé de propagation (Matthews et al., 2015). L'État de New-York l'a classée comme espèce prohibée et hautement invasive sur son territoire[70]. Pour des raisons mal comprise, la plante est aussi devenue invasive en Nouvelle-Angleterre à proximité de lieux où elle a été artificiellement introduite.
Aucun cas d'invasion n'est signalé à ce jour dans l'UE, mais des cas de dispersion spontanée de cette espèce à partir de ses monocultures (ou de jardins ?) sont déjà documentés en Europe, dont dans 15 des 16 Länder allemands, ainsi que dans plusieurs autres pays européens[71]. Dans les pays de l'Est (Ukraine et Russie, cette plante est déjà, pour les mêmes raisons, considérée comme potentiellement invasive (Matthews et al. 2015 ; Vinogradova et al. 2015 ; Zavialova 2017).
Le GBIF a archivé 4 mentions en Europe (dont 2 en France) pour la période 1848-1908. En 2024, il mentionne que l'espèce a été déclarée introduite dans 14 pays ou îles, et qu'elle figure dans les registres d'espèces introduites et invasives (Global Register of Introduced and Invasive Species)d'un nombre croissant de pays : Suède (235 occurrences), Ukraine (85), Russie (51), Belgique (80) Pologne (46) et dans 9 autres pays[71]. Aux Pays-Bas, une évaluation des risques écologiques (faite avant publication des preuves d'une possible dispersion efficace par hydrochoriej) lui reconnait un risque d'invasivité, mais faible. Des installations spontanées progressent en Europe, avec par exemple de premiers signalements au Luxembourg (en bordure de chemin et de pessière, en 2020-2021)[72].
Dans son aire d'origine, c'est une plante rivulaire ou souvent proche de l'eau, ce qui invite à penser qu'elle puisse disperser ses propagules (on parle de diaspores chez les plantes, ex . graines et/ou rhizomes) par hydrochorie[68] (comme c'est le cas par exemple pour la Renouée du Japon ou la Balsamine de l'Himalaya), par exemple suite à une crue, de fortes pluies ou un effondrement de berge. Pour être invasive, une plante doit avoir une bonne dispersion de ses diaspores[73]
Quatre études expérimentales récentes (publication 2024), faites en Allemagne et en Europe centrale, se sont pour la 1ère fois intéressé à la fois à la résistance des graines, à et leurs possibles modes de dispersion dans le paysage[68] :
- Anémochorie. Elle est faible : même avec des vitesses de vent atteignant 7 mètres par seconde, les graines n'ont pas été dispersées à plus de 4 ou 5 mètres[68] ;
- zoochorie. Les oiseaux et rongeurs, y compris européens, et pas uniquement les écureuils, contribuent dans la nature à disperser des graines et propagules. Ceci a été récemment confirmé et documenté par exemple par Aleksandra Wróbel et Rafał Zwolak en 2013[74] ; Suselbeek en 2014[75]; Bieberich et al. 2016[76] ; Lichti et al. 2017[77] ; Kempter et al. 2018[78]). Des graines ont expérimentalement été « offertes » à des rongeurs dans deux types habitats respectivement fermé et ouvert (forêt, pré), près d'un champ de Silphie. En forêt, les rongeurs (dont le campagnol Myodes glareolus et plusieurs espèces de souris sauvages (Apodemus sp), ont mangé sur place, ou enlevé 100 % des graines offertes ; chaque jour. Et curieusement, dans le pré, les graines offertes n'ont pas été touchées du tout. On ignore encore la part des graines qui pourraient être perdues ou stockées par ces rongeurs[68] ;
- hydrochorie. Les chercheurs ont observé le devenir de graines ayant passé 4 semaines dans l'eau non stagnante : dans ce délai, quelle que soit le temps passé dans l'eau, le taux de germination des graines a été « constamment élevé. La plupart des graines ont déjà germé dans l'eau au cours des deux premières semaines »[68]. Donc, « l'eau pourrait disperser les graines, qui conservent leur capacité de germination, sur de longues distances »[68]. Sur une surface d'eau stagnante, le vent peut aussi contribuer à pousser les graines sur l'eau ;
- anthropochorie : On ignore s'il existe des « échappées de jardins » parmi les cas signalés. Mais une dispersion par les engins est plausible. En effet, les machines agricoles qui font et transportent la récolte opèrent généralement en septembre. Elles diffusent probablement alors des graines sur de longues distances, le long des chemins ruraux et de routes notamment[68] ;
- géochorie : Stockées à la surface du sol et à 10 cm de profondeur, les graines ont presque toutes germé dès les deux premières années. Ceci indique qu'il n'y a pas de banque de graine à moyen ou long terme dans les 10 premiers cm du sol[68]. Cependant la même étude a montré qu'un tiers des graines stockées durant 4 ans à 30 cm de profondeur ont germé une fois mises à jour[68]. Sur cette base on s'attend à ce que quelques graines soient conservées durant environ 10 ans dans une « cryptobanque de graines du sol ». C'est un autre indice qui fait évoquer une capacité invasive ; d'autant que certaines invasives (ex. : Balsamine de l'Himalaya[79] ou la Berce du Caucase (Krinke et al.) se contentent d'une banque de graines peu persistantes. Des graines de Silphie enfouies par un labour, par une crue torrentielle, par des sangliers ou des rongeurs, puis remises à jour (par les mêmes voies éventuellement) 10 ans plus tard pourraient donc théoriquement faire réapparaitre une population là où on la pensait éteinte[68].
Au milieu des années 2020, le risque de dispersion et d'invasion est encore jugé faible en raison du peu de surfaces cultivés (ex. : moins de 1 000 ha pour toute l'Allemagne), mais il augmentera avec chaque nouvelle parcelle mise en culture[68]. Au vu du nombre actuel (2024) de ses occurences, « la Silphie perfoliée pourrait se propager et éventuellement devenir envahissante en Europe centrale ». Ils suggèrent des mesures visant à empêcher la dispersion et l'installation spontanée de cette plante en Europe[68].
On sait d'expérience que les plantes dites naturalisées, sont généralement passées par une phase d'adaptation environnementale (acclimatation) où elles se dispersent peu. Puis, soit elles trouvent un équilibre avec les déprédateurs et symbiotes locaux ; soit — grâces à certains « traits écologiques » — elles deviennent hyper-compétitives et donc invasives, pour une période indéterminée. Pour évaluer le caractère potentiellement envahissant de plantes candidates à de nouvelles mises en monocultures (pour les agrocarburants notamment), au moins deux protocoles d'évaluation des risques d'invasivité ont été mis au point ; qui chacun peuvent être modifié pour être adapté à divers types d'environnements et contextes locaux, afin d'y évaluer le caractère potentiellement envahissant d'espèces proposées en monocultures, et destinées à la production de biomasse-énergie (dont méthane et autres agrocarburants). Il existeune version australienne et une version américaine (l'US-WRA) de ce type d'outil[80]. Silphium perfoliatum ne semble pas avoir déjà été évaluée de la sorte. En Europe et Eurasie, ses impacts sont encore mal évalués, mais sa capacité potentielle à envahir des milieux naturels humides est admise (en Chine elle a par exemple été jugée faible sur l'île de Zhoushan par Bi Yuke et al. (2015) lors d'un bilan des plantes exotiques et de leur caractère envahissant a été fait sur l'île)[81]. Cette plante attire divers pollinisateurs, mais une étude chinoise a confirmé que comme beaucoup d'autre Compositae, Silphium perfoliatum peut s'autoféconder en l'absence de pollinisateurs. Seule la mauvaise germination de ses graines protège donc aujourd'hui les écosystèmes et les champs d'un plausible risque d'invasion.
En outre, aux États-Unis, en 2006, S. Raghu et ses collaborateurs, dans la revue Science, alertaient déjà sur le fait que les caractéristiques des plantes aujourd'hui recherchées par les producteurs de biocarburants tendaient de plus en plus à chevaucher celles des grandes espèces envahissantes : haute productivité, compétitivité par rapport aux mauvaises herbes et à la végétation autochtone, facilité de culture, résilience aux coupes successives, rusticité, faibles besoins en intrants, adaptabilité à divers types de sols (y compris difficiles et/ou pollués)[82]. Dans la plupart des contextes, Silphium perfoliatum répond à tous ces critères[83],[84],[85], hormis un seul : ses graines ont souvent de faibles taux de germination, mais pas toujours (notamment dans l'eau)[réf. souhaitée].
Certains en déduisent que cela limitera fortement son caractère potentiellement invasif, et/ou ils estiment que l'on pourrait récolter la plante avant que les graines n'atteignent leur pleine maturité (mais la floraison de la plante s'échelonne sur plusieurs mois, et la maturation des graines peut dans une certaine mesure se poursuivre sur une fleur coupée. De plus, la littérature montre des progrès dans la germination ou dans certains cas un bon taux de reprise, et que le transport par l'eau facilite la germination[68] (or, dans le cadre du dérèglement climatique, les risques d'orages, de fortes pluies et d'inondation augmentent).
D'autres considèrent que la plante semble actuellement ne pas se maintenir longtemps — autrement qu'en populations isolées — à proximité des zones où sa culture a été testée[86].
Un problème est que jusqu'en 2023, on ne comprenait pas encore la levée de dormance de ces graines ; et on ignore pourquoi leur germination est si variable et imprévisible. On sait maintenant que l'eau pourrait être un facteur important[68].
En Europe, c'est en Allemagne que les cultures intensives et à vocation énergétique de cette espèce ont commencé ; à partir de cultivars sélectionnés pour leur haute productivité. C'est donc là qu'on s'attend à voir de premiers indices d'invasivité. Des études agro-botaniques y ont confirmé, à la fin des années 2010, que dans les environnement qui lui conviennent, cette espèce se montre très compétitive voire invasive. Des cas d'occurrences et de propagations spontanées sont maintenant documentés dans sept Länders d'Allemagne, mais aussi dans d'autres pays européens[87],[88],[89],[90].
On a longtemps manqué de connaissance assez fines de ses besoins en terme d'habitat, et en termes d'évolution du climat (les pluies et inondations hivernales semblent devoir augmenter) pour pouvoir prédire si elle pourrait de venir invasive là où on l'introduit volontairement ou accidentellement[83].
On sait déjà que que :
- Cultivée, la Silphie perfoliée atteint son meilleur taux de croissance et de reproduction (hauteur d'environ 3 m et biomasse sèche de 1,5 kg, pour 350 capitules par plante au cours de la deuxième saison de croissance) sur des sols « périodiquement gorgées d'eau ou bien irriguées »[91],[7],[92],[83] et elle ne craint pas les inondations périodiques ; cependant, si le sol est tout le temps trop humide et plus encore s'il est trop sec, ce potentiel diminue significativement[83] (même si dans un loess profond, à Braunschweig, le Julius Kühn-Institut (Centre fédéral allemand de recherche sur les plantes cultivées) a observé que ses racines peuvent aller chercher l'eau jusqu'à 2,7 m de profondeur max., plus profondément que le maïs)[7]. De plus, notaient Walter Frölich et ses collègues en 2016 : « Une caractéristique qui a jusqu'à présent reçu peu d'attention est que le silphium n'est pas encore apparu comme plante hôte pour des ravageurs tels que la pyrale du maïs ou la chrysomèle des racines du maïs »[93]
- le nombre de pousses par plante, ainsi que le nombre de fruits par capitule sont, dans une certaine mesure, lié à la proximité des racines vis à vis de la nappe phréatique[83].
Les auteurs concluaient en 2022 qu'en Europe, « de précieux écosystèmes humides pourraient risquer un envahissement par le Silphium. Par conséquent, les champs pour la culture de cette espèce doivent être choisis avec soin et une certaine distance par rapport à ces écosystèmes doit être maintenue. La colonisation spontanée par la Silphie perfoliée doit être strictement surveillée afin de pouvoir lutter contre cette espèce si nécessaire »[83].
Utilisations[modifier | modifier le code]
Apiculture[modifier | modifier le code]
La silphie perfoliée fleurit de juin à septembre. Les abeilles y produisent un miel au léger goût d'agrumes, à raison d'environ 10 à 15 kg par ruche[31].
L'intérêt apicole de cette plante pourrait être maximisé dans les ZNT (zones de non traitement) et les zones proches des habitations car, à ce jour, sa rusticité lui permet de se passer de traitements chimiques (hormis la première année).
Usages alimentaires[modifier | modifier le code]
Diverses études ou essais ont porté sur l'intérêt de la Silphie dans l'alimentation animale, y compris pour les crevettes d'élevage (où Silphium perfoliatum L testée en Chine comme adjuvant alimentaire immunostimulant (dosée à 5%) semble pouvoir améliorer la croissance des crevettes et leur résistance aux maladies, dont en enrichissant leur flore intestinale, et en dopant l'activité enzymatique liée à l'immunodigestion dans leur hépatopancréas et intestin, peut être via l'activation de la transcription d'un gène lié à l'immunométabolisme dans le système digestif de la crevettes[94].
Pour l'Homme ou l'animal, la graine pourrait être source de complément alimentaire fonctionnels bénéfiques pour la santé, selon Kowalski et Wierciński (2004)[95].
Phytoépuration[modifier | modifier le code]
L'espèce a aussi fait l'objet de recherches (in situ, en environnement contrôlé, et en laboratoire), qui ont conclu à un intérêt pour la phytoépuration de certains sols par exemple pollués par des métaux lourds et métalloïdes[96],[97],[98], par l'Industrie minière notamment[99] ou pour épurer des eaux par phytoépuration[100]. Selon Ioana Crișan et al. (2024) les capacités de phytoextraction des métaux du sol par les cultures pérennes de ce type pourraient être améliorées en portant plus d'attention aux champignons mycorhiziens arbusculaires, car ils peuvent aider les plantes à mieux supporter la toxicité des métaux lourds[101].
En Lithuanie, une étude a porté sur les effets d'épandages de boues d'épuration sur sa productivité[102].
Aliment ?[modifier | modifier le code]
Pour les humains, la plante ne semble pas avoir été considérée comme un aliment intéressant, mais l'USDA note[11] « Les jeunes feuilles (cuites) de la plante ont autrefois été considérées, au printemps, comme un légume vert acceptable dans la région des prairies », d'après l'ethnobotaniste K Kindscher[103] en 1987.
Usages médicinaux, pharmaceutique ou de santé[modifier | modifier le code]
Les amérindiens du Nord utilisaient plusieurs parties de la silphie perfoliée pour se soigner, par exemple chez les Omaha[104], les Chippewa[105] ou Ojibwe[106].
Les rhizomes étaient considérées antiémétiques, antirhumatismales, analgésiques, toniques et diaphorétiques, et aussi utilisées comme remède gynécologique et contre le rhume. Depuis, on leur a trouvé un intérêt contre les maladies du foie et de la rate, et encore contre les fièvres, les ecchymoses internes, la débilité et les ulcères[107]. Des extraits éthanoliques de Silphium perfoliatum se sont montrés régénérateurs pour la cicatrisation des lésions post-brûlure chez les rats[107].
La plante contient des saponines et autres molécules intéressantes contre le cholestérol, dont des silphiosides trouvés dans les feuilles, qui ont fait chuté en laboratoire de 12 % et 19 % le taux de cholestérol de rats, selon la dose et la durée du traitement (selon Syrov et al. en 1992)[108]. Et Davidjanc et al. en 1997 ont aussi montré que les saponines de feuilles de Silphium perfoliatum inhibaient le développement du 3 champignon phytopathogène testés Drechslera graminea. (Rabh) Ito, Rhizopus nodosus. Namysl et Rhizopus nigricans. Dse[109].
Les plantes de ce genre sécrétant une substance odorante évoquant la térébenthine. L'huile essentielle de la Silphie perfoliée a été analysée (dans le rhizome, la feuille et l'inflorescence). La feuille en contient moins que la fleur qui en contient deux fois moins que le rhizome, et la composition de l'huile change à peine entre fleur et feuille, mais diffère plus dans le rhizome[110].
Des usages pharmaceutiques nouveaux sont évoqués, en raison de propriétés antibactériennes des extraits de feuilles, d'inflorescences et plus encore de rhizomes, avec une action contre des bactéries à Gram positif (Enterococcus faecalis, Staphylococcus aureus) et à Gram négatif (Escherichia coli, Pseudomonas aeruginosa bactéries). Tous les extraits étaient très actifs contre Staphylococcus aureus (Souches FDA 209P), un peu plus pour les alcoolatures que pour les extraits lipophiles[111].
Autres usages, effectifs ou envisagés[modifier | modifier le code]
- des molécules d'intérêt (ex. : molécules potentiellement fongicides[112] ou bactéricides[113] ; Glycosides triterpènes, ou encore les acides chlorogéniques, qui chez la souris, selon une première étude réduisent le taux de lipides sanguins, favorisent le métabolisme des acides gras insaturés dans le foie, réduisent la production d'acides gras saturés, et font perdre du poids et - in vivo comme in vitro - semble mieux protéger de la stéatose hépatique que la simvastatine)[114] susceptibles d'intéresser l'Industrie pharmaceutique et la chimie verte[115]
- On a testée la Silphie comme source de fibres ou particules riches en cellulose, hémicellulose et lignine, pour la fabrication de briquettes[116], panneaux de particules. Les panneaux obtenus sont moins solides qu'en épicéa, et ils ne sont qu'en partie biosourcés car agglomérés avec du diisocyanate de méthylène diphényle (MDI) ou des résines d'urée-formaldéhyde (UF), mais ils permettraient de moins surexploiter le bois[117] En Allemagne, la plante est aussi introduite dans de la pâte à papier, et utilisée pour produire du terreau[53]. Des matériaux isolants sont aussi envisageables[8].
- Le digestat, si la culture était "propre", présente l'intérêt de ne pas ou peu être contaminé par des résidus de pesticides et de pouvoir retourner au champs sous forme de biofertilisant, éventuellement sur la culture même, après les fauches pour doper les repousses. Les études disponibles citent un rapport C/N compris entre 12,1 et 12,8 ; une teneur en matière sèche proche de 7,0 % (soit 3 points de plus plus que celle observée pour Helianthus salicifolius), avec un taux de minéraux intéressant (environ 29 % de la MS) en cendres dans le digestat de Helianthus salicifolius était inférieure de près de 6,0 %[52].
- Une production d'huile végétale à partir de ses graines a été envisagée[62], mais une autre Silphie semble plus intéressante, capable de produire une huile comparable à l'huile de tournesol[118].
Prospective[modifier | modifier le code]
Alors que son espèce-soeur S. integrifolium est en cours de domestication pour la production d'huile, la culture de Silphium perfoliatum est encore trop nouvelle (dans le journal Crop Science, Van Tassel et al., en 2017, plaidaient pour une accélération de la domestication de cette plante, et la création de « nouveaux idéotypes de cultures et des stratégies de sélection éclairées par de multiples disciplines »)[118] et mal maitrisée en Europe pour que ses éventuels inconvénients et vulnérabilités soient bien identifiés pour les moyens et long termes (risque d'invasivité ou de pullulation d'un déprédateur notamment). Des progrès sont faits dans la réussite des semis[53], mais l'espèce présente encore de larges « variations biotypiques » (grande diversité de formes (phénotypes), hauteur, types biologiques et rendements) dont on ignore encore si elles ont des liens avec la résistance aux maladies et à divers stress environnementaux ; il faut donc mieux comprendre sa biologie et sa génétique[42] et sa sensibilité/vulnérabilité à divers agents pathogènes ou ravageurs potentiels[51], y compris face au dérèglement climatique.
En 2015, aucune étude n'avait encore porté sur les impacts locaux et globaux, éventuellement différés de l'éventuelle industrialisation de cette culture, considérée comme l'une des alternative prometteuse pour la production de matériaux biosourcés et de biogaz[51].
On sait qu'associer différentes cultures pérennes ensemble pourraient les rendre plus résistantes aux déprédateurs et plus résilientes, amis des études agro-phytosociologiques sont encore nécessaires pour savoir quelles associations seraient les plus efficaces selon les contextes[6].
Selon un groupe d'agronomes et universitaires américains : « Contrairement à la domestication prémoderne, la domestication de novo doit être intentionnelle et scientifique. Nous avons le luxe et l'obligation, à ce moment de l'histoire, d'élargir l'idéotype de domestication de la production alimentaire et énergétique pour inclure (i) les services écosystémiques axés sur les cultures importants pour la soutenabilité, (ii) la diversité génétique pour permettre le progrès de la reproduction pendant des siècles, (iii) les adaptations naturelles et les associations de microbiome conférant l'efficacité de l'utilisation des ressources et la tolérance au stress, et (iv) l'amélioration de la théorie de la domestication elle-même en surveillant les changements génétiques et écophysiologiques de Valeurs de référence de la prédomestication. Pour atteindre rapidement ces objectifs, il faudra utiliser le séquençage de nouvelle génération pour le développement de marqueurs et une équipe internationale et interdisciplinaire engagée dans la collaboration et la planification stratégique. »
C'est l'une des plantes qui pourraient peut-être à l'avenir fournir une rémunération aux agriculteurs pour le stockage de carbone[31].
Notes et références[modifier | modifier le code]
- Guide des fleurs sauvages de l'Est de l'Amérique du Nord, par Lawrence Newcomb, éditions Broquet, La Prairie (Québec), 1983.
- Faune et flore de l'Amérique Nord, Agnès Saint-Laurent, Sélection du Reader's Digest, Montréal (Québec), 1986.
- Tela Botanica, <https://www.tela-botanica.org>, licence CC BY-SA 4.0 <https://creativecommons.org/licenses/by-sa/4.0>, consulté le 22 avril 2024
- MNHN & OFB [Ed]. 2003-présent. Inventaire national du patrimoine naturel (INPN), Site web : https://inpn.mnhn.fr, consulté le 22 avril 2024
- Base de données des plantes vasculaires du Canada (VASCAN), consulté le 22 avril 2024
- (en) Lena Wöhl, Thorsten Ruf, Christoph Emmerling et Stefan Schrader, « Earthworm communities and their relation to above‐ground organic residues and water infiltration in perennial cup plant ( Silphium perfoliatum ) and annual silage maize ( Zea mays ) energy plants », Soil Use and Management, vol. 40, no 2, (ISSN 0266-0032 et 1475-2743, DOI 10.1111/sum.13041, lire en ligne, consulté le )
- (de) Siegfried Schittenhelm, Burkhard Schoo et Susanne Schroetter, « Ertragsphysiologie von Biogaspflanzen: Vergleich von Durchwachsener Silphie, Mais und Luzernegras », Journal für Kulturpflanzen, , p. 378–384 Seiten (DOI 10.5073/JFK.2016.12.06, lire en ligne, consulté le ).
- Martin Greve, Christoph Anton Conrad Korte, Johanna Entrup et Hanna Altrogge, Evaluation of the Intra- and Interspecific Development of Different Accessions of Silphium perfoliatum L. and Silphium integrifolium Michx., vol. 13, , 1601 p. (ISSN 2073-4395, DOI 10.3390/agronomy13061601, lire en ligne).
- (en) B.V. Shalyuta et E.V. Kostitskaya, The Yield of Silphium Perfoliatum L. Depending on the Conditions of Cultivation, vol. 22, , 91–97 p. (ISSN 2449-5999, DOI 10.1515/agriceng-2018-0019, lire en ligne).
- (en) David L. Van Tassel, Kenneth A. Albrecht, James D. Bever et Arvid A. Boe, Accelerating Silphium Domestication: An Opportunity to Develop New Crop Ideotypes and Breeding Strategies Informed by Multiple Disciplines, vol. 57, , 1274–1284 p. (ISSN 0011-183X, DOI 10.2135/cropsci2016.10.0834, lire en ligne).
- « USDA Plants Database », sur plants.usda.gov (consulté le ).
- Ladd, D. 1995. Tallgrass prairie wildflowers. Falcon Press, Helena, Montana.
- Wildflowers of the Tallgrass Prairie, University of Iowa Press, 6–264 p. (lire en ligne).
- « Silphie : une culture écologique d'avenir », sur L'Avenir Agricole de l'Ardèche, (consulté le ).
- http://www.lapresse.ca/le-soleil/maison/horticulture/201209/06/01-4571788-la-gentille-geante.php La gentille géante de Larry Hodgson, La Presse, septembre 2012.
- (en) Mark K. Leach et Thomas J. Givnish, « Ecological Determinants of Species Loss in Remnant Prairies », Science, vol. 273, no 5281, , p. 1555–1558 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.273.5281.1555, lire en ligne, consulté le ).
- (en) Robert Costanza, Ralph d'Arge, Rudolf de Groot et Stephen Farber, « The value of the world's ecosystem services and natural capital », Nature, vol. 387, no 6630, , p. 253–260 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/387253a0, lire en ligne, consulté le ).
- Johnson P, Boe A, Albrecht K et Torrez V.C. (oct. 2012). Recent discoveries and development in the entomology of bioenergy crop production. In Proceedings of the 2012 Sun Grant National Conference, New Orleans, LA (pp. 2-5)|url=https://www.researchgate.net/profile/P-Johnson-5/publication/330520510_RECENT_DISCOVERIES_AND_DEVELOPMENT_IN_THE_ENTOMOLOGY_OF_BIOENERGY_CROP_PRODUCTION/links/5c45bccd92851c22a384f599/RECENT-DISCOVERIES-AND-DEVELOPMENT-IN-THE-ENTOMOLOGY-OF-BIOENERGY-CROP-PRODUCTION.pdf .
- (en) Julianna K. Tuell, Anna K. Fiedler, Douglas Landis et Rufus Isaacs, « Visitation by Wild and Managed Bees (Hymenoptera: Apoidea) to Eastern U.S. Native Plants for Use in Conservation Programs », Environmental Entomology, vol. 37, no 3, , p. 707–718 (ISSN 0046-225X et 0046-225X, DOI 10.1603/0046-225x(2008)37[707:vbwamb]2.0.co;2, lire en ligne, consulté le ).
- (en) Jessica D. Davis, Stephen D. Hendrix, Diane M. Debinski et Chiara J. Hemsley, « Butterfly, bee and forb community composition and cross-taxon incongruence in tallgrass prairie fragments », Journal of Insect Conservation, vol. 12, no 1, , p. 69–79 (ISSN 1366-638X et 1572-9753, DOI 10.1007/s10841-006-9063-4, lire en ligne, consulté le ).
- (en) Ingolf Steffan-Dewenter, Simon G. Potts et Laurence Packer, « Pollinator diversity and crop pollination services are at risk », Trends in Ecology & Evolution, vol. 20, no 12, , p. 651–652 (DOI 10.1016/j.tree.2005.09.004, lire en ligne, consulté le ).
- (en) Simon G. Potts, Jacobus C. Biesmeijer, Claire Kremen et Peter Neumann, « Global pollinator declines: trends, impacts and drivers », Trends in Ecology & Evolution, vol. 25, no 6, , p. 345–353 (DOI 10.1016/j.tree.2010.01.007, lire en ligne, consulté le ).
- Axel Decourtye, Eric Mader et Nicolas Desneux, « Landscape enhancement of floral resources for honey bees in agro-ecosystems », Apidologie, vol. 41, no 3, , p. 264–277 (ISSN 0044-8435 et 1297-9678, DOI 10.1051/apido/2010024, lire en ligne, consulté le ).
- (en) Bauböck R, Karpenstein-Machan M, Kappas M (2014) Computing the biomass potentials for maize and two alternative energy crops, triticale and cup plant (Silphium perfoliatum L.), with the crop model BioSTAR in the region of Hannover (Germany). Environmental Sciences Europe 26, 19.
- IWI (2007) Presseinformation des Stockholm International Water Institute (SIWI). http://www.worldwaterweek.org/Downloads/WWW_2007_Press_Kit.pdf
- (de) Dauber, J., A.L. Müller, S. Schittenhelm, B. Schoo, Q. Schorpp, S. Schrader, S. Schroetter, 2016: Agrarökologische Bewertung der Durchwachsenen Silphie (Silphium perfoliatum L.) als eine Biomassepflanze der Zukunft. Schlussbericht FKZ 22004411 und FKZ 22037311. http://www.fnr-server.de/ftp/pdf/berichte/22037311.pdf (Stand: 22. September 2016).
- « Influence of drip irrigation on the height of the biennia cup plant (Silphium perfoliatum L.) from the micropropagation seedlings », Infrastruktura i Ekologia Terenów Wiejskich / Infrastructure and ecology of rural areas, no III/2/2015, , p. 779–786 (ISSN 1732-5587, DOI 10.14597/INFRAECO.2015.3.2.062, lire en ligne, consulté le ).
- « Silphium perfoliatum L. », sur Invasive Plant Atlas (consulté le ).
- « Silphium perfoliatum », sur Minnesota Wildflowers (consulté le ).
- « Cup Plant », sur Adirondack Park Invasive Plant Program, (consulté le ).
- « DECISIF : Décrire et Expertiser une Culture d'Intérêt : la Silphie perFoliée – RAIN », (consulté le ) ; voir aussi la synthèse des résultats de l'étude : https://rain-innovation.fr/wp-content/uploads/2022/11/2023_PEI-DECISIF_Synthese.pdf
- L. Celesti‐Grapow, A. Alessandrini, P. V. Arrigoni et E. Banfi, « Inventory of the non‐native flora of Italy », Plant Biosystems - An International Journal Dealing with all Aspects of Plant Biology, vol. 143, no 2, , p. 386–430 (ISSN 1126-3504 et 1724-5575, DOI 10.1080/11263500902722824, lire en ligne, consulté le ).
- (en) G. Galasso, F. Conti, L. Peruzzi et N. M. G. Ardenghi, « An updated checklist of the vascular flora alien to Italy », Plant Biosystems - An International Journal Dealing with all Aspects of Plant Biology, vol. 152, no 3, , p. 556–592 (ISSN 1126-3504 et 1724-5575, DOI 10.1080/11263504.2018.1441197, lire en ligne, consulté le ).
- Wei-Sheng Feng, Yuan-Yuan Pei, Xiao-Ke Zheng et Chun-Ge Li, « A new kaempferol trioside from Silphium perfoliatum », Journal of Asian Natural Products Research, vol. 16, no 4, , p. 393–399 (ISSN 1028-6020 et 1477-2213, DOI 10.1080/10286020.2013.823951, lire en ligne, consulté le ).
- Compositae Working Group (CWG). Global Compositae Database (GCD), consulté le 22 avril 2024
- Peni, D., Stolarski, M. J., Bordiean, A., Krzyżaniak, M., et Dębowski, M. (2020). Silphium perfoliatum—a herbaceous crop with increased interest in recent years for multi-purpose use. Agriculture, 10(12), 640.
- (en) B. Schoo, K. P. Wittich, U. Böttcher et H. Kage, « Drought Tolerance and Water‐Use Efficiency of Biogas Crops: A Comparison of Cup Plant, Maize and Lucerne‐Grass », Journal of Agronomy and Crop Science, vol. 203, no 2, , p. 117–130 (ISSN 0931-2250 et 1439-037X, DOI 10.1111/jac.12173, lire en ligne, consulté le ).
- Benjamin Mast, Andreas Lemmer, Hans Oechsner et Annett Reinhardt-Hanisch, Methane yield potential of novel perennial biogas crops influenced by harvest date, vol. 58, , 194–203 p. (ISSN 0926-6690, DOI 10.1016/j.indcrop.2014.04.017, lire en ligne).
- (en) Laura Cumplido-Marin, Anil R. Graves, Paul J. Burgess et Christopher Morhart, Two Novel Energy Crops: Sida hermaphrodita (L.) Rusby and Silphium perfoliatum L.—State of Knowledge, vol. 10, , 928 p. (ISSN 2073-4395, DOI 10.3390/agronomy10070928, lire en ligne).
- (en) Markus Gansberger, Hans-Peter Stüger, Manfred Weinhappel et Karl Moder, Germination characteristic of Silphium perfoliatum L. seeds, vol. 68, , 73–79 p. (ISSN 0006-5471, DOI 10.1515/boku-2017-0007, lire en ligne).
- Pichard, G. (2012) Management, Production, and Nutritional Characteristics of Cup-Plant (Silphium perfoliatum) in Temperate Climates of Southern Chile. Cienciae Investigación Agraria, 39, 61-77.
- Teshale Assefa, Jixiang Wu, Kenneth A. Albrecht et Paul J. Johnson, « Genetic Variation for Biomass and Related Morphological Traits in Cup Plant (<i>Silphium perfoliatum</i> L.) », American Journal of Plant Sciences, vol. 06, no 08, , p. 1098–1108 (ISSN 2158-2742 et 2158-2750, DOI 10.4236/ajps.2015.68114, lire en ligne, consulté le ).
- Niqueux M (1981) A new forage plant : Silphium perfoliatum L. [Compositae; a new French feed crop, feed value]. Fourrages
- Stanford, G. (1990). Silphium perfoliatum (cup-plant) as a new forage. Proceedings of Twelfth North American Prairie Conference, 33-37.
- Piłat J., Majtkowski W., Majtkowska G., Mikołajczak J., Góralska A. (2007). The usefulness for ensiling of chosen plant forms of species of Silphium genus. Journal of Central European Agriculture 8 (3), 363-368
- Duranti E, Santilocchi R, Casoli C (1988): Composizione chimica e valore nutritivo di Silphium perfoliatum. L. conservato mediante insilamento. Zoot Nutr Anim 14: 349–356
- (en) Dumitru Peni, Mariusz Jerzy Stolarski, Anna Bordiean et Michał Krzyżaniak, « Silphium perfoliatum—A Herbaceous Crop with Increased Interest in Recent Years for Multi-Purpose Use », Agriculture, vol. 10, no 12, , p. 640 (ISSN 2077-0472, DOI 10.3390/agriculture10120640, lire en ligne, consulté le ).
- Stanford, G. (1990, August). Silphium perfoliatum (cup-plant) as a new forage. In Proceedings of the twelfth North American prairie conference (Vol. 12, pp. 33-38). Cedar Falls: University of Northern Iowa
- Jürgen Franzaring, Ingo Holz, Zorica Kauf et Andreas Fangmeier, « Responses of the novel bioenergy plant species Sida hermaphrodita (L.) Rusby and Silphium perfoliatum L. to CO 2 fertilization at different temperatures and water supply », Biomass and Bioenergy, vol. 81, , p. 574–583 (ISSN 0961-9534, DOI 10.1016/j.biombioe.2015.07.031, lire en ligne, consulté le ).
- Victor Å¢áŽÅ¢EI, Alexandru TELEUŢĂ et Alexandru MUNTEAN, « The Perspective of Cultivation and Utilization of the Species Silphium Perfoliatum L. and Helianthus Tuberosus L. in Moldova », Bulletin of University of Agricultural Sciences and Veterinary Medicine Cluj-Napoca. Agriculture, vol. 70, no 1, , p. 160–166 (ISSN 1843-5386 et 1843-5246, DOI 10.15835/buasvmcn-agr:9780, lire en ligne, consulté le ).
- Markus Gansberger, Lucy F.R. Montgomery et Peter Liebhard, « Botanical characteristics, crop management and potential of Silphium perfoliatum L. as a renewable resource for biogas production: A review », Industrial Crops and Products, vol. 63, , p. 362–372 (ISSN 0926-6690, DOI 10.1016/j.indcrop.2014.09.047, lire en ligne, consulté le ).
- (en) Mariusz J. Stolarski, Dumitru Peni et Marcin Dębowski, « Biogas potential of cup plant and willow-leaf sunflower biomass », Energy, vol. 255, , p. 124559 (DOI 10.1016/j.energy.2022.124559, lire en ligne, consulté le ).
- « Synthèse des résultats du projet DECISIF : Décrire et Expertiser une Culture d'Intérêt : la Silphie perFoliée – RAIN », (consulté le ).
- « Anbautelegramm Durchwachsene Silphie », sur Thüringer Landesanstalt für Landwirtschaft (consulté le ).
- « Durchwachsene Silphie in Niedersachsen », sur Landwirtschaftskammer Niedersachsen (consulté le ).
- John Boardman, Mark L. Shepheard, Edward Walker et Ian D. L. Foster, « Soil erosion and risk-assessment for on- and off-farm impacts: A test case using the Midhurst area, West Sussex, UK », Journal of Environmental Management, vol. 90, no 8, , p. 2578–2588 (ISSN 0301-4797, DOI 10.1016/j.jenvman.2009.01.018, lire en ligne, consulté le ).
- (en) Nico Eisenhauer, Tomasz Dobies, Simone Cesarz et Sarah E. Hobbie, « Plant diversity effects on soil food webs are stronger than those of elevated CO 2 and N deposition in a long-term grassland experiment », Proceedings of the National Academy of Sciences, vol. 110, no 17, , p. 6889–6894 (ISSN 0027-8424 et 1091-6490, PMID 23576722, PMCID PMC3637779, DOI 10.1073/pnas.1217382110, lire en ligne, consulté le )
- (en) James P. Curry et Olaf Schmidt, « The feeding ecology of earthworms – A review », Pedobiologia, vol. 50, no 6, , p. 463–477 (DOI 10.1016/j.pedobi.2006.09.001, lire en ligne, consulté le )
- (en) Alexandru Milcu, Stephan Partsch, Reinhardt Langel et Stefan Scheu, « The response of decomposers (earthworms, springtails and microorganisms) to variations in species and functional group diversity of plants », Oikos, vol. 112, no 3, , p. 513–524 (ISSN 0030-1299 et 1600-0706, DOI 10.1111/j.0030-1299.2006.14292.x, lire en ligne, consulté le )
- (en) Thorsten Ruf, Jennifer Makselon, Thomas Udelhoven et Christoph Emmerling, « Soil quality indicator response to land‐use change from annual to perennial bioenergy cropping systems in Germany », GCB Bioenergy, vol. 10, no 7, , p. 444–459 (ISSN 1757-1693 et 1757-1707, DOI 10.1111/gcbb.12513, lire en ligne, consulté le )
- (en) Baoqing Chen, EnKe Liu, Qizhuo Tian et Changrong Yan, « Soil nitrogen dynamics and crop residues. A review », Agronomy for Sustainable Development, vol. 34, no 2, , p. 429–442 (ISSN 1774-0746 et 1773-0155, DOI 10.1007/s13593-014-0207-8, lire en ligne, consulté le )
- Johnson, P. et Boe, Arvid et Martens, Abigail. (2019). Eucosma gigantea (Riley) and Silphium perfoliatum L., Morphological variation in an insect-plant association in Eastern South Dakota. https://www.researchgate.net/profile/P-Johnson-5/publication/337168572_EUCOSMA_GIGANTEANA_RILEY_AND_SILPHIUM_PERFOLIATUM_L_MORPHOLOGICAL_VARIATION_IN_AN_INSECT-PLANT_ASSOCIATION_IN_EASTERN_SOUTH_DAKOTA/links/5dc991774585151435037494/EUCOSMA-GIGANTEANA-RILEY-AND-SILPHIUM-PERFOLIATUM-L-MORPHOLOGICAL-VARIATION-IN-AN-INSECT-PLANT-ASSOCIATION-IN-EASTERN-SOUTH-DAKOTA.pdf
- Arvid Boe, Kenneth A. Albrecht, Paul J. Johnson et Jixiang Wu, « Biomass Production of Cup Plant (Silphium perfoliatum L.) in Response to Variation in Plant Population Density in the North Central USA », American Journal of Plant Sciences, vol. 10, no 06, , p. 904–910 (ISSN 2158-2742 et 2158-2750, DOI 10.4236/ajps.2019.106065, lire en ligne, consulté le ).
- (en) Paul J. Johnson et Arvid Boe, « Three interesting insects and the cause of reduced vigor of cup plant (Silphium perfoliatum) in agronomic plantings », Proceedings of the South Dakota Academy of Science, vol. 90, , p. 209 (ISSN 0096-378X, e-ISSN 2573-1947, S2CID 85935379, résumé).
- Arvid Boe, Kenneth A. Albrecht, Paul J. Johnson et Jixiang Wu, « Biomass Production of Cup Plant (<i>Silphium perfoliatum</i> L.) in Response to Variation in Plant Population Density in the North Central USA », American Journal of Plant Sciences, vol. 10, no 06, , p. 904–910 (ISSN 2158-2742 et 2158-2750, DOI 10.4236/ajps.2019.106065, lire en ligne, consulté le ).
- Wilkaniec, Barbara, and Hanna Piekarska-Boniecka (2008) "Aphid infestation of decorative perennials." Acta Scientiarum Polonorum Hortorum Cultus 7.1 : 13-19 |url=https://czasopisma.up.lublin.pl/index.php/asphc/article/download/3666/2490
- Frölich, W., Brodmann, R., et Metzler, T. (2016). The cup plant (Silphium perfoliatum)-a story of success from agricultural practice. Journal für Kulturpflanzen, 68(12), 351-355.
- (en) L. Marie Ende, Lukas Hummel et Marianne Lauerer, « Dispersal and persistence of cup plant seeds (Silphium perfoliatum): do they contribute to potential invasiveness? », Plant Ecology and Evolution, vol. 157, no 1, , p. 75–87 (ISSN 2032-3921, DOI 10.5091/plecevo.104640, lire en ligne, consulté le ).
- article 3, n° 2 du règlement UE n° 1 143/2014
- Moore G (2009) New York non-native plant invasiveness ranking for Silphium perfoliatum. Http://www.nyis.info/user_uploads/d8be1_Silphium.perforatum.NYS.pdf
- (en) « Silphium perfoliatum L. », sur gbif.org (consulté le ).
- Krippel, Y., et Helminger, T. (2022). Notes floristiques. Observations faites au Luxembourg (2020-2021). Bulletin de la Société des naturalistes luxembourgeois, 124, 191-222. |url =https://www.researchgate.net/profile/Yves-Krippel/publication/364694331_Notes_floristiques_Observations_faites_au_Luxembourg_2020-_2021/links/63578a336e0d367d91c47bae/Notes-floristiques-Observations-faites-au-Luxembourg-2020-2021.pdf
- (en) Shaun R. Coutts et Rieks D. van Klinken, « What are the key drivers of spread in invasive plants: dispersal, demography or landscape: and how can we use this knowledge to aid management? », sur Biological Invasions, (ISSN 1387-3547, DOI 10.1007/s10530-010-9922-5, consulté le ), p. 1649–1661.
- (en) Aleksandra Wróbel et Rafał Zwolak, « The choice of seed tracking method influenced fate of beech seeds dispersed by rodents », Plant Ecology, vol. 214, no 3, , p. 471–475 (ISSN 1385-0237 et 1573-5052, DOI 10.1007/s11258-013-0183-0, lire en ligne, consulté le ).
- Rob Klinger et Marcel Rejmánek, « A strong conditional mutualism limits and enhances seed dispersal and germination of a tropical palm », Oecologia, vol. 162, no 4, , p. 951–963 (ISSN 0029-8549 et 1432-1939, DOI 10.1007/s00442-009-1542-3, lire en ligne, consulté le ).
- Judith Bieberich, « Acorns of introduced Quercus rubra are neglected by European Jay but spread by mice », Annals of Forest Research, vol. 59, no 1, (DOI 10.15287/afr.2016.522, lire en ligne, consulté le ).
- (en) Nathanael I. Lichti, Michael A. Steele et Robert K. Swihart, « Seed fate and decision‐making processes in scatter‐hoarding rodents », Biological Reviews, vol. 92, no 1, , p. 474–504 (ISSN 1464-7931 et 1469-185X, DOI 10.1111/brv.12240, lire en ligne, consulté le ).
- (en) Iris Kempter, Ursula Nopp‐Mayr, Christa Hausleithner et Georg Gratzer, « Tricky to track: comparing different tagging methods for tracing beechnut dispersal by small mammals », Ecological Research, vol. 33, no 6, , p. 1219–1231 (ISSN 0912-3814 et 1440-1703, DOI 10.1007/s11284-018-1640-y, lire en ligne, consulté le ).
- (en) Hana Skálová, Lenka Moravcová, Jan Čuda et Petr Pyšek, « Seed-bank dynamics of native and invasive Impatiens species during a five-year field experiment under various environmental conditions », NeoBiota, vol. 50, , p. 75–95 (ISSN 1314-2488 et 1619-0033, DOI 10.3897/neobiota.50.34827, lire en ligne, consulté le ).
- (en) D.R. Gordon, K.J. Tancig, D.A. Onderdonk et C.A. Gantz, « Assessing the invasive potential of biofuel species proposed for Florida and the United States using the Australian Weed Risk Assessment », Biomass and Bioenergy, vol. 35, no 1, , p. 74–79 (DOI 10.1016/j.biombioe.2010.08.029, lire en ligne, consulté le ).
- 毕玉科, 田旗, 卢钟玲, et 李宏庆. (2015). 舟山岛外来植物及其入侵性分析. 福建林业科技, 42(1), 151-159.
- (en) S. Raghu, R. C. Anderson, C. C. Daehler et A. S. Davis, « Adding Biofuels to the Invasive Species Fire? », Science, vol. 313, no 5794, , p. 1742–1742 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1129313, lire en ligne, consulté le ).
- (en) L. Marie Ende, Katja Knöllinger, Moritz Keil et Angelika J. Fiedler, « Possibly Invasive New Bioenergy Crop Silphium perfoliatum: Growth and Reproduction Are Promoted in Moist Soil », Agriculture, vol. 11, no 1, , p. 24 (ISSN 2077-0472, DOI 10.3390/agriculture11010024, lire en ligne, consulté le ).
- (de) L. Marie Ende et Marianne Lauerer, « Spontanvorkommen der Silphie im Bayreuther Raum: birgt diese neue Bioenergiepflanze ein Invasionspotenzial? », 0028-0615, vol. 95, no 7, , p. 310–315 (ISSN 0028-0615, DOI 10.17433/7.2020.50153819.310-315, lire en ligne, consulté le ).
- (en) L. Marie Ende et Marianne Lauerer, « Spreading of the cup plant (Silphium perfoliatum) in northern Bavaria (Germany) from bioenergy crops », NeoBiota, vol. 79, , p. 87–105 (ISSN 1314-2488 et 1619-0033, DOI 10.3897/neobiota.79.94283, lire en ligne, consulté le ).
- OFB & UICN France, « Fiche Silphium perfoliatum », sur Centre de ressources, (consulté le ).
- « Catalogue of Life : Silphium perfoliatum L. », sur www.catalogueoflife.org (consulté le ).
- Günter Brennenstuhl, « Beobachtungen zur Einbürgerung von Gartenflüchtlingen im Raum Salzwedel (Altmark) », Mitteilungen zur floristischen Kartierung in Sachsen-Anhalt, vol. 15, (ISSN 1432-8038, DOI 10.21248/mfk.154, lire en ligne, consulté le ).
- Ulrich Wölfel, « Zur Flora von Bitterfeld und Umgebung (11. Beitrag) », Mitteilungen zur floristischen Kartierung in Sachsen-Anhalt, vol. 18, (ISSN 1432-8038, DOI 10.21248/mfk.112, lire en ligne, consulté le ).
- Verbreitung der Farn- und Blütenpflanzen in Deutschland ; aggregiert im Raster der Topographischen Karte 1 :25000—Silphium perfoliatum. (Distribution des fougères et plantes à fleurs en Allemagne ; cartographie/topographie à la maille regroupées dans le quadrillage de la carte topographique 1:25000 — Silphium perfoliatum.)
- (en) Ruf, Audu, Holzhauser et Emmerling, « Bioenergy from Periodically Waterlogged Cropland in Europe: A First Assessment of the Potential of Five Perennial Energy Crops to Provide Biomass and Their Interactions with Soil », Agronomy, vol. 9, no 7, , p. 374 (ISSN 2073-4395, DOI 10.3390/agronomy9070374, lire en ligne, consulté le ).
- http://archive.sciendo.com/SGGW/sggw.2015.47.issue-4/sggw-2015-0031/sggw-2015-0031.pdf
- (de) Walter Frölich, Ralf Brodmann et Thomas Metzler, « Die Durchwachsene Silphie (Silphium perfoliatum L.) – ein Erfolgsbericht aus der Praxis », Journal für Kulturpflanzen, , p. 351–355 Seiten (DOI 10.5073/JFK.2016.12.01, lire en ligne, consulté le ).
- Yang Du, Xiaoman Hu, Jifeng Chen et Wenlong Xu, « Investigation of the effects of cup plant (Silphium perfoliatum L.) on the growth, immunity, gut microbiota and disease resistance of Penaeus vannamei », Fish & Shellfish Immunology, vol. 135, , p. 108631 (ISSN 1050-4648, DOI 10.1016/j.fsi.2023.108631, lire en ligne, consulté le ).
- Grażyna Kowalska, Urszula Pankiewicz et Radosław Kowalski, « Evaluation of Chemical Composition of Some Silphium L. Species as Alternative Raw Materials », Agriculture, vol. 10, no 4, , p. 132 (ISSN 2077-0472, DOI 10.3390/agriculture10040132, lire en ligne, consulté le ).
- Xingfeng Zhang, Hanping Xia, Zhian Li et Ping Zhuang, « Potential of four forage grasses in remediation of Cd and Zn contaminated soils », Bioresource Technology, vol. 101, no 6, , p. 2063–2066 (ISSN 0960-8524, DOI 10.1016/j.biortech.2009.11.065, lire en ligne, consulté le ).
- Włodzimierz Majtkowski, Piotr Szulc, Jerzy Gaca et Jan Mikołajczak, « Ocena wykorzystania Silphium perfoliatum L. w fitoremediacji terenów zanieczyszczonych metalami ciężkimi », Biuletyn Instytutu Hodowli i Aklimatyzacji Roślin, no 256, , p. 163–169 (ISSN 2657-8913 et 0373-7837, DOI 10.37317/biul-2010-0039, lire en ligne, consulté le ).
- Majtkowski, W., Szulc, P.M. Gaca, J., Mikołajczyk, J. (2010). Assessment of the use of Silphium perfoliatum L. in phytoremediation of sites contaminated with heavy metals. Biuletyn IHAR 256, 163-169.
- Radu L. Sumalan, Cornelia Muntean, Ana Kostov et Daniel KržAnović, « The cup plant (Silphium perfoliatum L.) – a viable solution for bioremediating soils polluted with heavy metals », Notulae Botanicae Horti Agrobotanici Cluj-Napoca, vol. 48, no 4, , p. 2095–2113 (ISSN 1842-4309 et 0255-965X, DOI 10.15835/nbha48412160, lire en ligne, consulté le ).
- (en) Xingfeng Zhang, Hanping Xia, Zhian Li et Ping Zhuang, « Potential of four forage grasses in remediation of Cd and Zn contaminated soils », Bioresource Technology, vol. 101, no 6, , p. 2063–2066 (DOI 10.1016/j.biortech.2009.11.065, lire en ligne, consulté le ).
- (en) Ioana Crișan, Raffaella Balestrini et Chiara Pagliarani, « The current view on heavy metal remediation: The relevance of the plant interaction with arbuscular mycorrhizal fungi », Plant Stress, vol. 12, , p. 100439 (DOI 10.1016/j.stress.2024.100439, lire en ligne, consulté le ).
- Gintaras ŠIAUDINIS et Danutė KARČAUSKIENĖ, « THE EFFECT OF SEWAGE SLUDGE ON AND CUP PLANT'S (SILPHIUM PERFOLIATUM L.) BIOMASS PRODUCTIVITY UNDER WESTERN LITHUANIA'S RETISOL », Proccedings of International Scientific Conference "RURAL DEVELOPMENT 2017", Aleksandras Stulginskis University, (DOI 10.15544/rd.2017.027, lire en ligne, consulté le ).
- Kindscher K (1987). Edible wild plants of the prairie: an ethnobotanical guide. University of Kansas Press, Lawrence, Kansas.
- Gilmore MR (1913): A study in the ethnobotany of the Omaha Indians. Nebrasca State Hist Soc Coll 17: 314–357.
- Densmore F (1928): Uses of plants by the Chippewa Indians. SI-BAE Ann Rep 44: 273–379.
- Smith HH (1932): Etnobotany of the Ojibwe Indians. Bull Publ Museum Milwaukee 4: 365.
- Kujanceva AM, Davidjanc ES (1988): Silphium perfoliatum. extract's regeneration activity. Farmacija Moskwa 6: 36–37.
- Syrov WN, Chušbaktova ZA, Davidjanc ES (1992): The triterpene glicosides of Silphium. perfoliatum. L. Hypolipidaemic activity of silphiozyd. Chim Farm Żurnal 26: 66–69.
- Davidjanc ES, Kartaševa IA, Nešin IW (1997): The effect of triterpene glycosides of Silphium perfoliatum. L. on phytopathogenic fungi. Rast Resursy 4: 93–98.
- (en) R. Kowalski et T. Wolski, « The chemical composition of essential oils of Silphium perfoliatum L. », Flavour and Fragrance Journal, vol. 20, no 3, , p. 306–310 (ISSN 0882-5734 et 1099-1026, DOI 10.1002/ffj.1418, lire en ligne, consulté le ).
- Radosław Kowalski et Bogdan Kędzia, « Antibacterial Activity ofSilphium perfoliatum. Extracts », Pharmaceutical Biology, vol. 45, no 6, , p. 494–500 (ISSN 1388-0209 et 1744-5116, DOI 10.1080/13880200701389409, lire en ligne, consulté le ).
- emiołkowska, A., Kowalski, R. (2012). In vitro estimate of influence of Silphium perfoliatum L. leaves extract on some fungi colonizing the pepper plants. Acta Sci. Pol. Hort. Cult., 11(3), 43-55
- Radosław Kowalski et Bogdan Kędzia, « Antibacterial Activity ofSilphium perfoliatum. Extracts », Pharmaceutical Biology, vol. 45, no 6, , p. 494–500 (ISSN 1388-0209 et 1744-5116, DOI 10.1080/13880200701389409, lire en ligne, consulté le ).
- (en) Jiyu Xu, Wenjing Jia, Guoying Zhang et Liying Liu, « Extract of Silphium perfoliatum L. improve lipid accumulation in NAFLD mice by regulating AMPK/FXR signaling pathway », Journal of Ethnopharmacology, vol. 327, , p. 118054 (DOI 10.1016/j.jep.2024.118054, lire en ligne, consulté le ).
- Eleonora Sergeyevna Davidyants, « The effect of purified amount of triterpene glycosides and their enriched extract from leaves of sylphium perfoliatum », chemistry of plant raw material, no 4, , p. 441–448 (ISSN 1029-5143 et 1029-5151, DOI 10.14258/jcprm.2019045482, lire en ligne, consulté le ).
- Wróbel, M., Frączek, J., Francik, S., Slipek, Z., Mudryk, K. (2013). Influence of degree of frgmentation on chosen quality parameters of briquette made from biomass of cup plant Silphium perfoliatum L.. Conference Engineering for Rural Development, Jelgava, Latvia, 653-657
- Petr Klímek, Peter Meinlschmidt, Rupert Wimmer et Burkhard Plinke, « Using sunflower (Helianthus annuus L.), topinambour (Helianthus tuberosus L.) and cup-plant ( ilphium perfoliatum L.) stalks as alternative raw materials for particleboards », Industrial Crops and Products, vol. 92, , p. 157–164 (ISSN 0926-6690, DOI 10.1016/j.indcrop.2016.08.004, lire en ligne, consulté le ).
- (en) David L. Van Tassel, Kenneth A. Albrecht, James D. Bever et Arvid A. Boe, « Accelerating Silphium Domestication: An Opportunity to Develop New Crop Ideotypes and Breeding Strategies Informed by Multiple Disciplines », Crop Science, vol. 57, no 3, , p. 1274–1284 (ISSN 0011-183X et 1435-0653, DOI 10.2135/cropsci2016.10.0834, lire en ligne, consulté le ).
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- (en) Dumitru Peni, Mariusz Jerzy Stolarski, Anna Bordiean et Michał Krzyżaniak, « Silphium perfoliatum—A Herbaceous Crop with Increased Interest in Recent Years for Multi-Purpose Use », Agriculture, vol. 10, no 12, , p. 640 (ISSN 2077-0472, DOI 10.3390/agriculture10120640, lire en ligne, consulté le ).
- (en) Radosław Kowalski, « Analysis of lipophilic fraction from leaves, inflorescences and rhizomes of Silphium perfoliatum L. », Acta Societatis Botanicorum Poloniae, vol. 74, no 1, , p. 5–10 (ISSN 2083-9480, DOI 10.5586/asbp.2005.001, lire en ligne, consulté le ).
- (en) Martin Greve, Christoph Anton Conrad Korte, Johanna Entrup et Hanna Altrogge, Evaluation of the Intra- and Interspecific Development of Different Accessions of Silphium perfoliatum L. and Silphium integrifolium Michx., vol. 13, , 1601 p. (ISSN 2073-4395, DOI 10.3390/agronomy13061601, lire en ligne).
Liens externes[modifier | modifier le code]
- (en) Référence Catalogue of Life : Silphium perfoliatum L. (consulté le ).
- (fr + en) Référence GBIF : Silphium perfoliatum L. (consulté le ).
- (en) Référence Global Compositae Database (GCD) : Silphium perfoliatum L. (consulté le ).
- (fr) Référence INPN : Silphium perfoliatum L., 1759 (TAXREF) (consulté le ).
- (en) Référence IPNI : Silphium perfoliatum L. (consulté le ).
- (fr + en) Référence ITIS : Silphium perfoliatum L. (consulté le ).
- (en) Référence NCBI : Silphium perfoliatum (taxons inclus) (consulté le ).
- (en) Référence OEPP : Silphium perfoliatum Linnaeus (consulté le ).
- (en) Référence POWO : Silphium perfoliatum L. (consulté le ).
- (fr) Référence Tela Botanica (France métro) : Silphium perfoliatum L. 1759 (consulté le ).
- (en) Référence Tropicos : Silphium perfoliatum L. (+ liste sous-taxons) (consulté le ).
- (fr) Référence VASCAN : Silphium perfoliatum Linnaeus (consulté le ).
- (en) Référence World Flora Online (WFO) : Silphium perfoliatum L. (+descriptions) (consulté le ).
- (en) Référence WoRMS : espèce Silphium perfoliatum L. (consulté le ).