Température de flamme adiabatique

Dans l'étude de la combustion, la température de flamme adiabatique est la température atteinte par une flamme dans des conditions idéales. C'est la limite supérieure de la température qui peut être atteinte dans les processus réels.
Il y a deux types de température de flamme adiabatique : à volume constant et à pression constante, selon comment le processus se déroule. La température de flamme adiabatique à volume constant est la température qui résulte d'un processus de combustion complet qui se produit sans aucun travail, transfert thermique ou variation de l'énergie cinétique ou potentielle. Cette température est plus élevée que celle du processus à pression constante car aucune énergie n'est utilisée pour changer le volume du système (c'est-à-dire, produire du travail).
Flammes courantes[modifier | modifier le code]

Dans la vie quotidienne, la grande majorité des flammes rencontrées sont celles causées par une oxydation rapide d'hydrocarbures dans des matériaux tels que le bois, la cire, la graisse, les plastiques, le propane et l'essence. La température de flamme adiabatique à pression constante de ces substances dans l'air se situe dans un domaine relativement étroit autour de 1950°C. Ceci est principalement dû au fait que la chaleur de combustion de ces composés est en gros proportionnelle à la quantité d'oxygène consommée, qui accroît proportionnellement la quantité d'air qui doit être chauffée, et donc l'effet d'une chaleur de combustion plus importante sur la température de flamme est réduit. Une réaction incomplète à plus haute température réduit encore l'effet d'une chaleur de combustion plus importante.
Parce que la majorité des processus de combustion qui surviennent naturellement ont lieu à l'air libre, il n'y a rien qui confine le gaz dans un volume particulier tel que le cylindre d'un moteur à pistons. En conséquence, ces substances brûleront à pression constante, ce qui permet au gaz de se dilater lors du processus.
Températures de flamme de combustibles courants[modifier | modifier le code]
En supposant des conditions initiales atmosphériques (1 bar et 20 °C), le tableau ci-dessous[1] liste la température de flamme pour des combustibles variés sous des conditions de pression constante. Les températures mentionnées ici sont pour un mélange stœchiométrique comburant-oxydant (c'est-à-dire un rapport équivalent φ = 1).
On notera que ce sont des températures de flamme théoriques et non réelles, produites par une flamme qui ne perd pas de chaleur. La température réelle la plus proche sera celle de la partie la plus chaude d'une flamme, où la réaction de combustion est la plus efficace. Ceci suppose également une combustion complète (c'est-à-dire parfaitement équilibrée, sans fumée, habituellement avec une flamme bleuâtre). Plusieurs valeurs du tableau s'écartent significativement de celles de la bibliographie[1] ou de prévisions par des calculateurs en ligne.
| Combustible | Oxydant 1 bar 20 °C |
||
|---|---|---|---|
| (°C) | (°F) | ||
| Acétylène (C2H2) | Air | 2500 | 4532 |
| Oxygène | 3480 | 6296 | |
| Butane (C4H10) | Air | 2231 | 4074[2] |
| Cyanogène (C2N2) | Oxygène | 4525 | 8177 |
| Dicyanoacétylène (C4N2) | Oxygène | 4990 | 9010 |
| Essence | Air | 2138 | 3880[3] |
| Éthane (C2H6) | Air | 1955 | 3551 |
| Éthanol (C2H5OH) | Air | 2082 | 3779[3] |
| Hydrogène (H2) | Air | 2254 | 4089[3] |
| Oxygène | 3200 | 5792 | |
| Magnésium (Mg) | Air | 1982 | 3600[4] |
| Méthane (CH4) | Air | 1963 | 3565[5] |
| Gaz naturel | Air | 1960 | 3562[6] |
| Méthanol (CH3OH) | Air | 1949 | 3540[5] |
| Naphta | Air | 2533 | 4591[2] |
| Pentane (C5H12) | Air | 1977 | 3591[5] |
| Propane (C3H8) | Air | 1980 | 3596[7] |
| Méthylacétylène (CH3CCH) |
Air | 2010 | 3650 |
| Oxygène | 2927 | 5301 | |
| Toluène (C7H8) | Air | 2071 | 3760[5] |
| Bois | Air | 1980 | 3596 |
| Kérosène | Air | 2093[8] | 3801 |
| Fioul léger | Air | 2104[8] | 3820 |
| Fioul moyen | Air | 2101[8] | 3815 |
| Fioul lourd | Air | 2102[8] | 3817 |
| Houille | Air | 2172[8] | 3943 |
| Anthracite | Air | 2180[8] | 3957 |
| Oxygène | ≈ 3500[9] | ≈ 6332 | |
| Aluminium | Oxygène | 3732 | 6750[5] |
| Lithium | Oxygène | 2438 | 4420[5] |
| Phosphore (blanc) | Oxygène | 2969 | 5376[5] |
| Zirconium | Oxygène | 4005 | 7241[5] |
Aspects thermodynamiques[modifier | modifier le code]

D'après le premier principe de la thermodynamique pour un système réactif fermé on a
où et sont la chaleur et le travail transférés du système à l'environnement lors du processus, respectivement, et et sont l'énergie interne des réactifs et des produits, respectivement.
Dans le cas de la température de flamme adiabatique à volume constant, le volume du système est maintenu constant et donc il n'y a pas de travail produit ou consommé :
Il n'y a pas non plus de transfert de chaleur car le processus est supposé adiabatique : . Par conséquent, l'énergie interne des produits est égale à l'énergie interne des réactifs : . Comme il s'agit d'un système fermé, la masse des produits et des réactifs est identique et le premier principe peut être écrit en termes de masse :
- .

Dans le cas de la température de flamme adiabatique à pression constante, la pression du système est maintenue constante, ce qui donne l'équation suivante pour le travail :
De nouveau, il n'y a pas de transfert de chaleur car le processus est supposé adiabatique : . D'après le premier principe, on trouve :
En reprenant la définition de l'enthalpie on obtient . Comme il s'agit d'un système fermé, la masse des produits et des réactifs est la même et le premier principe peut être écrit en termes de masse :
- .
On voit que la température de flamme adiabatique du processus à pression constante est plus faible que celle du processus à volume constant. Ceci parce qu'une partie de l'énergie produite lors de la combustion va, sous forme de travail, dans le changement du volume du système contrôlé.
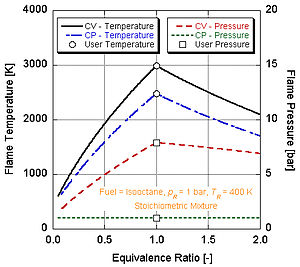
Si on fait l'hypothèse que la combustion est complète (c'est-à-dire en formant seulement CO2 et H2O), on peut calculer la température de flamme adiabatique à la main soit dans les conditions stœchiométriques soit pour une stœchiométrie "pauvre" (excès d'air). Ceci car il y a assez de variables et d'équations molaires pour équilibrer les côtés gauche et droit de l'équation :
Pour une stœchiométrie "riche" il n'y a pas assez de variables car la combustion ne peut être complète, avec au moins CO et H2 nécessaires pour l'équilibre molaire (ce sont les produits les plus courants d'une combustion incomplète) :
Cependant, si l'on prend en compte la réaction du gaz à l'eau :
et qu'on utilise la constante d'équilibre de cette réaction, on a assez de variables pour terminer le calcul.
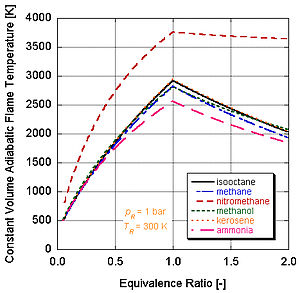
Différents combustibles avec différents niveaux d'énergie et de constituants molaires auront des températures de flamme adiabatiques différentes.
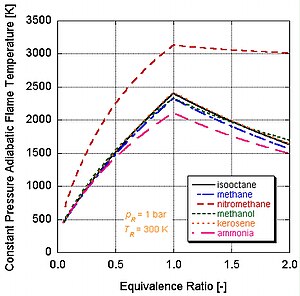
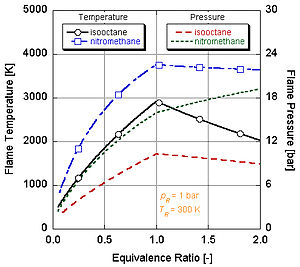
On peut voir sur la figure de droite pourquoi le nitrométhane (CH3NO2) est souvent utilisé comme "power boost" dans les moteurs automobiles. Puisque chaque molécule de nitrométhane contient un oxydant avec des liaisons à relativement haute énergie entre l'azote et l'oxygène, il peut brûler à plus haute température que les hydrocarbures ou le méthanol contenant de l'oxygène. Ceci est équivalent à l'ajout d'oxygène pur, qui augmente également la température de flamme adiabatique. Cette température plus élevée lui permet de créer plus de pression lors d'un processus à volume constant. Plus la pression est élevée, plus la force agissant sur le piston est élevée, créant plus de travail et plus de puissance dans le moteur. Il conserve une stœchiométrie relativement riche car il contient son propre oxydant. Cependant, faire tourner en continu un moteur au nitrométhane finira par faire fondre le piston et/ou le cylindre à cause de cette température plus élevée.

Dans les applications du monde réel, la combustion complète n'est que rarement possible. La chimie indique que la dissociation et la cinétique modifieront la composition des produits. Il existe plusieurs programmes disponibles qui peuvent calculer la température de flamme adiabatique en prenant en compte la dissociation par le biais des constantes d'équilibre (Stanjan, NASA CEA, AFTP). La figure de droite illustre que les effets de la dissociation tendent à diminuer la température de flamme adiabatique. Ceci résultat peut s'expliquer par le principe de Le Chatelier.
Références[modifier | modifier le code]
- Voir sous "Tables" dans les références externes ci-dessous.
- (en) Angela Libal, « What Temperatures Do Lighters Burn At? », sur Sciencing, Leaf Group Ltd. / Leaf Group Media, (consulté le ).
- (en) N. S. Borate, « Flame Temperature Analysis and NOx Emissions for Different Fuels », Michigan Technological University, (consulté le ).
- (en) « How hot does magnesium burn? | Reference.com » [archive du ] (consulté le ).
- (en) CRC Handbook of Chemistry and Physics, 96e éd., p. 15-51.
- (en) « North American Combustion Handbook, Volume 1, 3rd edition, North American Mfg Co., » [archive du ], (consulté le ).
- (en) « ME 96 - Flame Temperature Measurement Experiment (Archived copy) » [archive du ] [PDF], California Institute of Technology (consulté le ).
- (en) Hsin Chu, « Power Point Presentation: Flame Temperature (archivé depuis l'original) », Department of Environmental Engineering, National Cheng Kung University, Taiwan, .
- (en) Jongsup Hong et al., « Analysis of oxy-fuel combustion power cycle utilizing a pressurized coal combustor » [PDF], MIT qui cite (en) IPCC Special Report on Carbon Dioxide Capture and Storage, Intergovernmental Panel on Climate Change, (lire en ligne [PDF]), p. 122. Mais le rapport IPCC fait en réalité un commentaire beaucoup moins précis : "La combustion directe de combustible et d'oxygène a été pratiquée pendant de nombreuses années dans les industries métallurgiques et verrières où les brûleurs fonctionnent dans des conditions quasi-stœchiométriques avec des températures de flamme allant jusqu'à 3500°C." La température dépend de la pression, car à basse pression il y a une dissociation plus importante des produits de combustion, conduisant à une température adiabatique plus faible.
Liens externes[modifier | modifier le code]
Information générale[modifier | modifier le code]
- (en) Vytenis Babrauskas, « Temperatures in flames and fires » [archive du ], Fire Science and Technology Inc., (consulté le )
- « Computation of adiabatic flame temperature », Cerfacs (consulté le )
- « Adiabatic flame temperature », MIT (consulté le )
Tables[modifier | modifier le code]
- (en) « Adiabatic Flame Temperature » [archive du ], The Engineering Toolbox (consulté le ) adiabatic flame temperature of hydrogen, methane, propane and octane with oxygen or air as oxidizers
- (en) « Flame Temperatures for some Common Gases » [archive du ], The Engineering Toolbox (consulté le )
- (en) « Temperature of a blue flame and common materials », The Physics Factbook (consulté le )
Calculateurs[modifier | modifier le code]
- (en) « Online adiabatic flame temperature calculator », Cerfacs (consulté le ) utilisant le logiciel open source Cantera
- Adiabatic flame temperature program
- (en) « program for performing chemical equilibrium calculations », Gaseq (consulté le )
- Flame Temperature Calculator - Constant pressure bipropellant adiabatic combustion
- (en) « Adiabatic Flame Temperature calculator », Colorado State University - College of Engineering

















