Triphénylbismuth
| Triphénylbismuth | |

| |
| Identification | |
|---|---|
| Nom UICPA | triphénylbismuthane |
| No CAS | |
| No ECHA | 100.009.122 |
| No CE | 210-033-4 |
| PubChem | 11774 |
| SMILES | |
| InChI | |
| Apparence | solide blanc |
| Propriétés chimiques | |
| Formule | C18H15Bi |
| Masse molaire[1] | 440,292 1 ± 0,015 5 g/mol C 49,1 %, H 3,43 %, Bi 47,46 %, |
| Propriétés physiques | |
| T° fusion | 76 à 81 °C |
| Solubilité | insoluble dans l'eau |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le triphénylbismuth est une substance organique élémentaire dérivée de l'arylbismuth comportant trois cycles aromatiques et un métal central : le bismuth(III). Il se présente sous forme de cristaux blancs et trouve ses applications dans de nombreux domaines de la chimie.
Caractéristiques[modifier | modifier le code]
La triphénylbismuth est un solide cristallin blanc, facile à manipuler et stable. Sa température de cristallisation est de 78 à 80 °C. Il est facilement soluble dans le benzène, le dichlorométhane, l'éther, le THF et l'acétate d'éthyle, mais très peu soluble dans l'hexane et insoluble dans l'eau[2].
La basicité protonique (pKb) du triphénylbismuth a été estimée à 8,81 par une méthode potentiométrique dans l’acide acétique[3].
Le moment dipolaire du triphénylbismuth est nul dans le benzène, le cyclohexane et l’octane. Cette observation suggère deux hypothèses : soit chaque groupe Ph-Bi est apolaire, soit les moments dipolaires des trois liaisons Ph-Bi sont compensés par celui du doublet non liant[2].
La distance de liaison Bi-C dans le triphénylbismuth est de 2,24 Å, et l’angle C-Bi-C mesure 94°, ce qui indique une faible contribution de l’hybridation des orbitales 6s-6p sur le bismuth[4].
Synthèse[modifier | modifier le code]
La première synthèse du triphénylbismuth fut réalisée par De Katelaere et al. en 1971, en faisant réagir un halogénure de bismuth(III) anhydre avec un organomagnésien[5].
Chimie[modifier | modifier le code]
Le triphénylbismuth, par son caractère d’acide de Lewis et sa faible toxicité, permet son utilisation dans des réactions de couplage en tant que source de nucléophile aromatique[6], mais également dans des réactions de protection/déprotection et dans des processus d’oxydation[7].
En effet, ces systèmes réactionnels, souvent catalytiques, sont parfois utilisés en milieu aqueux ou sans solvant et impliquent un métal de faible toxicité. Or les composés à base de bismuth(III) ont une toxicité faible par rapport à celle d’autres métaux lourds dont la toxicité augmente généralement avec leur position dans le tableau périodique[8].
La décomposition thermique du triphénylbismuth à 192-224 °C permet d’obtenir de l’éthylène, du butane et notamment des butylènes, en majorité dans la phase gazeuse[9].
Utilisation[modifier | modifier le code]
Le triphénylbismuth est principalement utilisé pour la formation de liaisons carbone. De par ses propriétés, il est utilisé dans de nombreuses réactions telles que des réactions de couplage croisé, spécialement médiées par la catalyse au palladium à l’aide d’halogénures d'aryles[10].
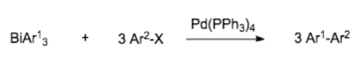
Il trouve également son application dans des réactions de couplage avec des dérivés d'halogénures de l’adduit de Baylis Hillman[11].

Par ailleurs, son utilisation est décrite dans la réaction de Heck[12]. On le retrouve également dans des réactions de O-arylation et C-arylation[13].
Données spectroscopiques[modifier | modifier le code]
Spectroscopie d'absorption[modifier | modifier le code]
Le triphénylbismuth montre des absorptions caractéristiques λmax à 248 et 280 nm. La bande à 280 nm serait due à la transition p-p* du benzène tandis que celle à 248 nm proviendrait de la réaction de dissociation du triphénylbismuth[14].
Spectroscopie vibrationnelle[modifier | modifier le code]
Récemment, deux équipes de chercheurs ont étudié les spectres vibrationnels du triphénylbismuth en utilisant la nomenclature de Whiffen pour assigner les différentes fréquences observées[15].
Spectroscopie IR et Raman[modifier | modifier le code]
Équipe de Shobatake[modifier | modifier le code]
Shobatake et ses collaborateurs ont rapporté les spectres IR et Raman du triphénylbismuth dans une solution de benzène et dans le Nujol. Dans la solution de benzène, la vibration t, qui est la principale vibration d'étirement des éléments phényls lourds, est attribuée à des bandes fortes à 237 et 220 cm−1 en spectroscopie IR. Ils ont également observé une bande moyennement polarisée à 237 cm−1 et une bande dépolarisée (un épaulement) à 219 cm−1 en spectroscopie Raman.
À l'état solide, les spectres IR et Raman sont plus complexes ; de ce fait, les conclusions quant à la structure du triphénylbismuth n’ont été déduites que des spectres en solution[16].
Équipe de Parrett[modifier | modifier le code]
En accord avec Shobatake et ses collègues, Parrett attribue la vibration t aux bandes à 235 et 225 cm−1 dans le spectre infrarouge et aux bandes à 236 et 223 cm−1 dans le spectre Raman. La vibration u, cependant, est assignée à une bande moyennement polarisée à 216 cm−1 et un épaulement à 199 cm−1 dans le spectre infrarouge et une bande forte à 210 cm−1 et un épaulement à 201 cm−1 dans le spectre Raman.
Les affectations pour la vibration y sont similaires pour les deux équipes de recherche, mais les affectations pour la vibration x diffère[17].
Symétrie[modifier | modifier le code]
L’équipe de Shobatake conclut, sur la base de leurs données spectrales, que le triphénylbismuth possède soit une symétrie C3, soit une symétrie C3n, ces deux groupes ne pouvant pas être distingués au moyen des données spectrales observées[16]. Cependant, une comparaison des modes d'étirement et de flexion (t et u) avec ceux calculés sur la base de la symétrie C3n a donné une excellente concordance entre les valeurs observées et théoriques, ce qui favorise l’hypothèse de cette symétrie[15].
Spectroscopie RMN 1H[modifier | modifier le code]
En spectroscopie RMN du proton dans le chloroforme deutéré (CDCl3), le spectre montre la résonance des protons en ortho, méta et para à respectivement 8,7 ppm, 7,4 ppm et 7,39 ppm. Le bismuth ayant un spin de 9/2, le triphénylbismuth révèle quatre pics dont les fréquences sont : n1 = 29,785 Hz, n2 = 55,214 Hz, n3 = 83,516 Hz et n4 = 111,438 Hz.
La constante de couplage de ce quadruplet (eQqzz) a pour valeur 669,06 ± 0,13 MHz, ce qui indique que les liaisons du bismuth ont un caractère s à 8-9 % (spectre NQR = résonance quadripolaire nucléaire ou RMN à champ magnétique nul)[18].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Hitomi Suzuki, Naoki Komatsu, Takuji Ogawa, Toshihiro Murafuji, Tohru Ikegami et Yoshihiro Matano, Organobismuth Chemistry, Elsevier Science, , 636 p. (ISBN 978-0-08-053815-0, lire en ligne), p. 60
- (en) Kolling, O.W. et Mawdsley, E.A., « Protonic Basicity of Periodic Group Va Triaryls », Inorganic Chemistry, , p. 408
- (en) Hawley, D.M. et Ferguson, G., « The stereochmistry of some organic dérivatives of Group VB elements. The crystal and molecular structure of triphenlbismuth », Journal of the Chemical Society A: Inorganic Physical, Theoretical,
- (en) De Ketelaere, R. F., Delbeke, F. T. et Van der kelen, G. P., « Organo group VB chemistry III. Synthesis and NMR spectra of some tertiary substituted arylstibines and arylbismuthines », Journal of organometallic chemistry, , p. 365
- (en) R. Ding, C.-S. Ge, Y.-J. Chen, D. Wang et C.-J. Li, « Rhodium-catalyzed reactions of arylbismuth and aryllead reagents with a chiral glyoxylate hydrate in air and water: water-promoted diastereoselectivity enhancement », Tetrahedron Letters, , p. 7789
- S. Antoniotti et E. Duñach, « Utilisations récentes de dérivés du bismuth en synthèse organique », Comptes Rendus Chimie, , p. 679–688
- (en) N.I. Sax et R.J. Lewis, Dangerous properties of industrial materials, Van Nostrand Reinhold, , 7e éd., p. 283
- (en) Hitomi Suzuki et Yoshihiro Matano, Organobismuth chemistry, Amsterdam, Elsevier, , 620 p., chap. 2, p. 62
- (en) Rao, M. L. N., Yamazaki, O., Shimada, S., Tanaka, T., Suzuki, Y. et Tanaka, M., « Palladium-catalyzed cross-coupling reaction of triarylbismuths with aryl halides and triflates », Organic Letters, , p. 3, 4103
- (en) Rao, M. L. N., Banerjee, D. N. et Dhanorkar, R. J., « Pd (0)-catalyzed couplings using bromide and chloride derivatives of Baylis–Hillman adducts with triarylbismuths as atom-efficient multi-coupling nucleophiles », Tetrahedron Letters, , p. 66, 3623
- (en) Kawamura, T., Kikukawa, K., Takagi, M. et Matsuda, T. Bull, « Reaction of Coordinated Phosphines. III. Reaction of Phenyl Compounds of Typical Groups V and VI Elements with Palladium(II) Salts in the Presence of Olefinic Compounds », Chemical Society of Japan, , p. 46, 2910
- (en) Elliott, G. I. et Konopelski, J.-P., « Arylation with organolead and organobismuth reagents », Tetrahedron Letters, , p. 57, 5683
- (en) Rao, C.N.R., Ramachandran, J. et Balasubramanian, A., « The Infrared and the near-ultraviolet absorption spectra of polyphenyl derivatives of the elements of groups IVb and Vb », Canadian Journal of Chemistry, , p. 59,171
- (en) Leon D. Freedman et G. O. Doak, « Preparation, reactions, and physical properties of organobismuth compounds », Chemical Reviews, vol. 82, no 12,
- (en) Shobatake, K., Postmus, C., Ferraro, J. R. et Nakamoto, K., « Vibrational Spectra of Triphenyl Compounds of Group VA Elements », Applied Spectroscopy, , p. 23, 12.
- (en) F.W.Parrett, « The vibrational spectra of some solid phenyl derivatives of group Vb elements », Spectrochimica Acta Part A: Molecular Spectroscopy, , p. 26A, 1271
- (en) H. G. Robinson, H. G. Dehmelt et Walter Gordy, « Pure Nuclear Quadrupole Spectrum of Bi209 in Bismuth-Triphenyl », Physical Reviews, , p. 89, 1305
