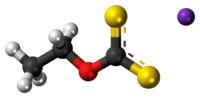
Éthylxanthate de potassium
| Éthylxanthate de potassium | ||
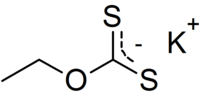
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom systématique | O-éthylcarbonodithioate de potassium | |
| No CAS | ||
| No ECHA | 100.004.946 | |
| PubChem | 2735045 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre jaune, odeur désagréable[1] | |
| Propriétés chimiques | ||
| Formule | C3H5KOS2 |
|
| Masse molaire[2] | 160,3 ± 0,013 g/mol C 22,48 %, H 3,14 %, K 24,39 %, O 9,98 %, S 40,01 %, |
|
| Propriétés physiques | ||
| T° fusion | 209 à 210 °C (décomposition)[1] | |
| Solubilité | 1 090 g·L-1 (eau, 20 °C) | |
| Précautions | ||
| SGH[1] | ||
| H228, H302, H315, H319, H332, H335, EUH018, P210, P260 et P305+P351+P338 |
||
| Transport[1] | ||
| Écotoxicologie | ||
| DL50 | 308 mg·kg-1 (souris, oral)[3] 199 mg·kg-1 (souris, i.v.)[4] 500 mg·kg-1(souris, i.p.)[5] 1 700 mg·kg-1 (rat, oral)[6] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'éthylxanthate de potassium est un composé organosulfuré de la famille des xanthates (dithiocarbonates) de formule CH3CH2OCS2K. Il est notamment utilisé dans l'industrie minière comme agent de flottation pour la séparation des minerais. Contrairement à l'éthylxanthate de sodium, le sel de potassium existe à l'état anhydre.
Propriétés[modifier | modifier le code]
L'éthylxanthate de potassium se présente sous la forme d'une poudre jaune à l'odeur désagréable. Il est stable ä pH élevé, mais s'hydrolyse rapidement pour des pH inférieurs à 9, à 25 °C. Contrairement à son équivalent au sodium, il cristallise en sel anhydre et est non-hygroscopique. L'éthylxanthate de potassium est un composé inflammable. Il se décompose vers 210 °C, avant de pouvoir fondre, dégageant du disulfure de carbone, hautement inflammable (point d'auto-inflammation de 90 °C).
Synthèse[modifier | modifier le code]
L'éthylxanthate de potassium fut synthétisé pour la première fois en 1822 par le chimiste danois William Christopher Zeise à partir d'hydroxyde de potassium, de disulfure de carbone et d'éthanol[7]. C'est toujours cette méthode qui est utilisé de nos jours : c'est la réaction entre un alcoolate, ici l'éthanolate, et le disulfure de carbone qui produit un xanthate. L'alcoolate est lui produit in situ, par réaction entre un alcool (ici l'éthanol), et une base forte (ici l'hydroxyde de potassium)[8] :
- CH3CH2OH + CS2 + KOH → CH3CH2OCS2K + H2O
Applications[modifier | modifier le code]
L'éthylxanthate de potassium est utilisé dans l'industrie minière comme agent de flottation pour la séparation des minerais de cuivre, nickel et argent[9]. Cette méthode exploite l'affinité de ces métaux « mous » avec le ligand organosulfure.
L'éthylxanthate de potassium est un réactif utile pour la production de thiocétones, par la réaction avec les dichlorures[10], mais également d'esters de xanthate à partir d'halogénures d'alkyle et d'aryle. Ces esters sont ensuite des intermédiaires utiles en synthèse organique[11].
L'éthylxanthate de potassium a fait l'objet de recherches comme conservateur, comme réactif de précipitation, et au Japon pour l'extraction liquide-liquide du technétium et du rhénium.
Notes et références[modifier | modifier le code]
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Potassium ethyl xanthate » (voir la liste des auteurs) et en allemand « Kalium-O-ethyldithiocarbonat » (voir la liste des auteurs).
- Entrée « Potassium O-ethyl dithiocarbonate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 septembre 2019 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Gigiena Truda i Professional'nye Zabolevaniya. Labor Hygiene and Occupational Diseases. Vol. 29(11), Pg. 51, 1985.
- Chvapil M, Zahradnik R, Cmuchalova B., « Influence of alcohols and potassium salts of xanthogenic acids on various biological objects. », Archives Internationales de Pharmacodynamie et de Therapie, vol. 135, , p. 330-343 (PMID 13879442)
- Domer FR, Schuler FW., « X-ray protection of certain sulf-hydryl compounds and their precursors in mice. », Archives Internationales de Pharmacodynamie et de Therapie, vol. 127, , p. 128-131 (PMID 13723622)
- Gigiena i Sanitariya. For English translation, see HYSAAV. Vol. 41(6), Pg. 95, 1976.
- (de) « Kaliumdithiocarbonate », sur Römpp Online, Georg Thieme Verlag (consulté le )
- Charles C. Price and Gardner W. Stacy, p-nitrophenyl) sulfide, Org. Synth. 28, coll. « vol. 3 », , 82 p., p. 667
- Kathrin-Maria Roy, « Xanthates », dans Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, (DOI 10.1002/14356007.a28_423){{Article encyclopédique}} : l'usage du paramètre
|périodique = Wiley-VCHlaisse présager- soit d'une confusion entre les modèles
{{article encyclopédique}}et{{article}} - soit d'une confusion entre les paramètres
périodiqueetéditeur.
Merci de consulter la documentation des modèles et de corriger l'article. - soit d'une confusion entre les modèles
- Alexander Schönberg et Emil Frese, « Organische Schwefelverbindungen, LIV. Synthesen von Thiocarbonylverbindungen durch Einwirkung von Kaliumxanthogenat oder Thioharnstoffen auf gem. Dichloride », Chemische Berichte, vol. 101, no 2, , p. 701–715 (ISSN 0009-2940, DOI 10.1002/cber.19681010241)
- Fabien Gagosz and Samir Z. Zard, A Xanthate-Transfer Approach to α-Trifluoromethylamines, Org. Synth. 84, coll. « vol. 11 », , 32 p., p. 212



