Éthylxanthate de sodium
| Éthylxanthate de sodium | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | éthoxymethanedithioate de sodium | |
| Nom systématique | O-éthylcarbonodithioate de sodium | |
| No CAS | ||
| No ECHA | 100.004.947 | |
| No CE | 205-440-9 | |
| PubChem | 23690437 8824 |
|
| SMILES | ||
| InChI | ||
| Apparence | cristaux ou poudre jaunes, odeur désagréable rappelant le disulfure de carbone[1] | |
| Propriétés chimiques | ||
| Formule | C3H5NaOS2 |
|
| Masse molaire[2] | 144,191 ± 0,013 g/mol C 24,99 %, H 3,5 %, Na 15,94 %, O 11,1 %, S 44,48 %, |
|
| Propriétés physiques | ||
| T° fusion | 69 à 69,5 °C[1] | |
| T° ébullition | décomposition[1] | |
| Solubilité | totalement soluble dans l'eau[1] | |
| Masse volumique | 1,263 g·cm-3[1] | |
| Précautions | ||
| SGH[3] | ||
| H228, H311, H314, H318, H372, H411 et H302+H332 |
||
| Écotoxicologie | ||
| LogP | -2,24[1] | |
| Composés apparentés | ||
| Autres cations | Éthylxanthate de potassium | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
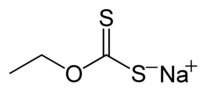
L'éthylxanthate de sodium est un composé organosulfuré de la famille des xanthates (dithiocarbonates) de formule CH3CH2OCS2Na. Il est notamment utilisé dans l'industrie minière comme agent de flottation pour la séparation des minerais[4].
Propriétés[modifier | modifier le code]
C'est un solide jaune pâle à l'odeur désagréable rappelant celle du disulfure de carbone, souvent présent sous la forme d'un dihydrate. Il est relativement stable dans l'eau à pH élevé, s'il n'est pas chauffé. Il s'hydrolyse rapidement à pH <9 à 25 °C. Il est la base conjuguée d'un acide fort inconnu, de pKa de 1,6 et pKb estimé à 12,4.
Décomposition dans l'eau[modifier | modifier le code]
Les xanthates sont susceptibles d'être hydrolysés et oxydés[5] :
- hydrolyse à pH faible :
- C2H5OCS2Na + H+ → C2H5OH + CS2 + Na+
- Oxydation par le dioxygène :
- 2 C2H5OCS2− + H2O + 1/2 O2 → (C2H5OCS2)2 + 2 OH−
Ces réactions nécessitent des conditions acides.
Production[modifier | modifier le code]
Comme la plupart des xanthates, l'éthylxanthate de sodium peut être préparé par réaction entre l'éthanolate de sodium avec le disulfure de carbone[6] :
- CH3CH2ONa + CS2 → CH3CH2OCS2Na
Détection[modifier | modifier le code]
L'éthylxanthate de sodium peut être identifié par ses pics d'absorption dans l'infrarouge (1179, 1160, 1115, 1085 cm−1) et l'ultraviolet (300 nm). Il existe aussi six méthodes de détection chimique.
- La méthode iodométrique qui repose sur l'oxydation en dixanthogène par le diiode, le produit étant détecté par un indicateur d'amidon. Cette méthode n'est cependant pas sélective et est susceptible de subir les interférences dues à la présence d'autres composés sulfurés[7].
- Le xanthate peut réagir avec le sulfate de cuivre ou le tartrate de cuivre, produisant des résidus de xanthate de cuivre détectables à l'iode. Cette méthode à l'avantage de ne pas être sensible aux éventuels sulfites, thiosulfates et carbonates[8].
- La méthode de détection acide-base, où une solution aqueuse diluée de xanthate est mise à réagir avec une grande quantité d'acide chlorhydrique à 0,01 M, produisant du disulfure de carbone et de l'alcool, qui sont ensuite dosés. L'excès d'acide et les impuretés sont éliminés par filtrage et titrage[8].
- La méthode argentométrique, où l'éthylxanthate de sodium est mis à réagir avec une solution diluée de nitrate d'argent. Le xanthate d'argent produit est titré par une solution aqueuse de nitrate de fer à 10 %. Cette méthode présente le désavantage du coût de l'agent, ainsi que le noircissement du xanthate d'argent par le nitrate d'argent qui réduit la précision de détection[8].
- La méthode mercurimétrique, dans laquelle le xanthate est dissout dans un solution aqueuse de diméthylamine à 40 %, puis chauffé et titré avec du O-hydroxymercuribenzoate. Le produit est détecté par la thiofluorescéine[8].
- La méthode à l'acide perchlorique implique la dissolution du xanthate dans de l'acide acétique sans eau. Le produit est ensuite titré avec de l'acide perchlorique et détecté avec du violet de gentiane[8].
L'éthylxanthate de sodium peut être quantifié par gravimétrie, en pesant les résidus de xanthate de plomb formé par réaction de l'éthylxanthate avec une solution de nitrate de plomb à 10 %. Il existe également des méthodes de détection électrochimiques qui peuvent être utilisées en combinaison avec les méthodes chimiques[8].
Applications[modifier | modifier le code]
L'éthylxanthate de sodium principalement utilisé dans l'industrie minière comme agent de flottation pour la séparation des minerais, pour récupérer des métaux tels que le cuivre, le nickel, l'argent ou l'or, ainsi que les sulfures et oxydes de métaux solides des slurries de minerai. Cette application fut introduite par Cornelius H. Keller en 1925.
Le principe derrière le procédé est le fait que la partie polarité de la molécule de xanthate s'attache aux particules de minerai, alors que les parties hydrocarbures apolaires se rassemblent pour former une couche hydrophobe. Les particules sont ensuite amenées à la surface de l'eau par des bulles d'air. Cette séparation efficace, et seules des petites quantités de xanthates sont requises, de l'ordre 300 g par tonne de minerai. Plus la chaîne carbonée est longue, plus l'action hydrophobe augmente, mais plus la sélectivité baisse. Cette chaîne est la plus courte pour l'éthylxanthate, ce qui le rend très sélectif pour les minerais de cuivre, de nickel, de plomb, d'or, et de zinc. On utilise en général des solutions aqueuses (à 10 %) à pH=7–11[9].
En 2000, l'Australie a produit 10 000 tonnes d'éthylxanthate de sodium et en a importé environ 6 000 tonnes, principalement de Chine[10]. Le produit d'Australie est appelé « liquid sodium ethyl xanthate », et est une solution aqueuse à 40 %[11]. Il est obtenu par réaction entre le disulfure de carbone avec l'hydroxyde de sodium et l'éthanol dans un processus fermé[12]. Sa masse volumique est de 1,2 g/cm3 et son point de fusion est de −6 °C[13].
L'éthylxanthate de sodium est aussi utilisé comme défoliant, herbicide et comme additif au caoutchouc pour le rendre plus résistant au dioxygène et à l'ozone[14].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sodium ethyl xanthate » (voir la liste des auteurs).
- Entrée « Ethyl sodium xanthate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 septembre 2019 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- fiche ECHA
- Kathrin-Maria Roy, « Xanthates », dans Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, (DOI 10.1002/14356007.a28_423){{Article encyclopédique}} : l'usage du paramètre
|périodique = Wiley-VCHlaisse présager- soit d'une confusion entre les modèles
{{article encyclopédique}}et{{article}} - soit d'une confusion entre les paramètres
périodiqueetéditeur.
Merci de consulter la documentation des modèles et de corriger l'article. - soit d'une confusion entre les modèles
- Report 5 (1995) pp. 14–16
- Ingram, G.; Toms, B. A., « The reactions of sodium ethyl xanthate with ethanol and with water. », Journal of the Chemical Society (Resumed), , p. 117-127 (DOI 10.1039/JR9610000117)
- Report 5 (1995) p. 8
- Report 5 (1995) p. 9
- Report 5 (1995) p. 13
- Report 5s (2000) p. 1
- Report 5s (2000) p. 3
- Report 5s (2000) p. v
- Report 5s (2000) p. 7
- Report 5 (1995), p. 2, citing Rao, R.S., “Xanthates and Related Compounds”, Marcel Dekker, New York, 1971 (ISBN 0-8247-1563-2) and Keller, C.H. (1925) Modèle:US Patent "Concentration of gold, sulphide minerals and uranium oxide minerals by flotation from ores and metallurgical plant products"




