Acide 2,4-dihydroxybenzoïque
| Acide 2,4-dihydroxybenzoïque | |

| |
| Identification | |
|---|---|
| Nom systématique | acide 2,4-dihydroxybenzoïque |
| Synonymes |
acide β-résorcylique |
| No CAS | |
| No ECHA | 100.001.770 |
| No CE | 201-946-9 |
| DrugBank | DB02839 |
| PubChem | 1491 |
| ChEBI | 89942 |
| FEMA | 3798 |
| SMILES | |
| InChI | |
| Apparence | poudre couleur crème clair, inodore[1] |
| Propriétés chimiques | |
| Formule | C7H6O4 [Isomères] |
| Masse molaire[3] | 154,120 1 ± 0,007 2 g/mol C 54,55 %, H 3,92 %, O 41,52 %, |
| pKa | 3,30 (COOH)[2] 9,12 (para-OH)[2] 15,6 (ortho-OH)[2] |
| Propriétés physiques | |
| T° fusion | 208 à 211 °C (décomposition)[4] |
| Solubilité | 8 g·L-1 (eau, 20 °C)[4] soluble dans l'éthanol et l'éther[5] |
| Précautions | |
| SGH[4] | |
| H315, H319, H335, P261, P280, P302+P352 et P305+P351+P338 |
|
| Écotoxicologie | |
| DL50 | 800 mg·kg-1 (souris, i.p.)[6] |
| LogP | 1,63[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide 2,4-dihydroxybenzoïque ou acide β-résorcylique est un composé organique aromatique de formule C7H6O4, dérivé à la fois de l'acide benzoïque et de la résorcine (1,3-dihydroxybenzène). Sa structure consiste en un cycle de benzène auquel est attaché un groupe carboxyle (-COOH) et deux groupes hydroxyle (-OH). C'est l'un des six isomères de l'acide dihydroxybenzoïque.
Synthèse[modifier | modifier le code]
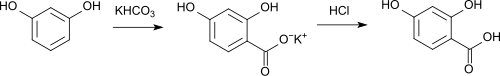
L'acide 2,4-dihydroxybenzoïque peut être synthétisé à partir de la résorcine et du bicarbonate de potassium par réaction de Kolbe[7],[8]
Réactions et dérivés[modifier | modifier le code]
La bromation de l'acide 2,4-dihydroxybenzoïque par le dibrome dans l'acide acétique glacial conduit initialement à l'acide 5-bromo-2,4-dihydroxybenzoïque qui peut être converti en 4-bromorésorcine par décarboxylation[9]. Avec une addition supplémentaire de brome, le dérivé 3,5-dibromo est formé. Si ce dernier est traité avec de l'acide nitrique, la 4,6-dinitro-2-bromorésorcine est formée par départ du groupe carboxyle et d'un atome de brome[10],[11].

Comme pour la bromation, la nitration se produit initialement en position 5. Si le processus est poursuivi avec de l'acide nitrique fumant, un deuxième groupe nitro viendra se substituer en position 3. Un traitement ultérieur à l'acide nitrique produit de l'acide styphnique[12]. Dans les dérivés mononitro et dinitro, le groupe carboxyle peut être éliminé par chauffage, ce qui donne la 4-nitrorésorcine ou la 2,4-dinitrorésorcine[13]. L'acide 5-nitro-2,4-dihydroxybenzoïque peut être réduit avec de l'étain et de l'acide chlorhydrique pour obtenir le composé aminé correspondant[12].

La chloration par le dichlore gazeux introduit dans une solution chaude d'acide acétique glacial de l'acide 2,4-dihydroxybenzoïque, a également lieu en position 5 (acide 5-chloro-2,4-dihydroxybenzoïque) et, en excès de chlore, produit le dérivé 3,5-dichloro[14],[15]. L'acide 5-chloro-2,4-dihydroxybenzoïque se condense avec la résorcine ou la chlororésorcine en tétrahydroxybenzophénones, qui réagissent ensuite par fermeture de cycle pour donner les 7-chloro-3,6-dihydroxyxanthones équivalentes. Si l'on utilise de l'acide 5-nitroïque au lieu de l'acide 5-chlorique, la réaction s'arrête à la cétone et il n'y a pas de fermeture de cycle[16].

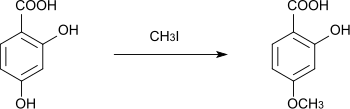
Lors de la réaction avec l'iodométhane dans le méthanol, seul le groupe hydroxyle para est initialement méthylé, ce qui donne l'acide 2-hydroxy-4-méthoxybenzoïque[17]. La méthylation du second groupe hydroxyle est difficile[17]. L'iodoéthane peut également être utilisé pour obtenir du p-monoéthyléther[18].
Lors du chauffage prolongé d'une solution aqueuse du sel de sodium de l'acide 2,4-dihydroxybenzoïque (acide β-résorcylique), une isomérisation partielle en acide 2,6-dihydroxybenzoïque (acide γ-résorcylique) a lieu[19]
Un proche parent est l'acide orsellinique, qui diffère de l'acide 2,4-dihydroxybenzoïque par un groupe méthyle en position 6.
Notes et références[modifier | modifier le code]
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « 2,4-Dihydroxybenzoesäure » (voir la liste des auteurs).
- « Fiche du composé 2,4-Dihydroxybenzoic acid », sur Alfa Aesar (consulté le ).
- B. N. Mattoo, « On the Complete Dissociation of 2:4 Dihydroxy Benzoic (β-Resorcylic) Acid », Zeitschrift für Physikalische Chemie, vol. 22, nos 3–4, , p. 187–198 (DOI 10.1524/zpch.1959.22.3_4.187)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « 2,4-Dihydroxybenzoic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 septembre 2020 (JavaScript nécessaire).
- Free Online Encyclopedia: β-resorcylic acid, consulté le 31 janvier 2017.
- R W Grady, J H Graziano, H A Akers, A Cerami, « The development of new iron-chelating drugs », Journal of Pharmacology and Experimental Therapeutics, vol. 196, no 2, , p. 478-85 (PMID 1255491)
- Johann Ambrosius Barth, Organikum, , 19e éd. (ISBN 3-335-00343-8), p. 351–352
- S. v. Kostanecki, « Zur Einführung der Carboxylgruppe in die Phenole », Berichte der deutschen chemischen Gesellschaft, vol. 18, , p. 3202–3206 (lire en ligne)
- {{{title}}}, Org. Synth., coll. « vol. »
- F. v. Hemmelmayr, « Über einige neue Derivate der Dioxybenzoesäuren », Monatshefte für Chemie, vol. 33, , p. 971–998 (DOI 10.1007/BF01552742)
- J. Zehenter, « Über einige Derivate der α-Dioxybenzoesäure », Monatshefte für Chemie, vol. 2, , p. 468–483 (DOI 10.1007/BF01516530)
- F. v. Hemmelmayr, « Über die Einwirkung von Salpetersäure auf β-Resorcylsäure und einige Derivate der letzteren », Monatshefte für Chemie, vol. 25, no 1, , p. 21–45 (DOI 10.1007/BF01540190)
- F. v. Hemmelmayr, « Über Nitroderivate der β-Resorcylsäure [2,4-Dioxybenzencarbonsäure », Monatshefte für Chemie, vol. 26, no 2, , p. 185–198 (DOI 10.1007/BF01532170)
- F. Hemmelmayr, T. Meyer, « Über den Einfluß verschiedener Substituenten auf die Haftfestigkeit der Karboxylgruppen in substituierten aromatischen Säuren. Einfluß einer zweiten Karboxylgruppe und relative Wirkung von Chlor und Brom », Monatshefte für Chemie, vol. 46, , p. 143–156 (DOI 10.1007/BF01558962)
- R. B. Sandin, R. A. McKee, « Orientation in the Benzene Ring. The Preparation of 5-Chloro-β-resorcylic Acid », J. Am. Chem. Soc., vol. 57, no 6, , p. 1077–1078 (DOI 10.1021/ja01309a032)
- R. Kurduker, N. V. Subba Rao, « Search for physiologically active compounds », Proceedings of the Indian Academy of Sciences – Section A, vol. 57, no 5, , p. 280–287 (DOI 10.1007/BF03049025)
- F. Tiemann, A. Parrisius, « Ueber Abkömmlinge des Resorcins », Berichte der deutschen chemischen Gesellschaft, vol. 13, , p. 2354–2381 (lire en ligne)
- S. v. Kostanecki, J. Tambor, « Ueber die Constitution des Fisotins », Berichte der deutschen chemischen Gesellschaft, vol. 28, , p. 2302–2309 (lire en ligne)
- D. K. Hale, A. R. Hawdon, J. I. Jones and D. I. Packham, « The carboxylation of resorcinol and the separation of β-and γ-resorcylic acid by ion-exchange chromatography », J. Chem. Soc., no 671, , p. 3503–3509 (DOI 10.1039/JR9520003503)