Réaction d'hydratation
En chimie organique, la réaction d’hydratation est une addition électrophile d'une molécule d'eau sur un composé organique.
Cette réaction s'opère typiquement dans l'eau en présence d'un acide fort (par exemple H2SO4), dans le but d'obtenir des ions hydronium (H3O+). Elle nécessite parfois un catalyseur, puisque l'eau ne peut réagir seule avec un alcène. En particulier, les enzymes catalysant les réactions chimiques d'hydratation dans les cellules (notamment pour la spirale catabolique de Lynen et la glycolyse) sont appelées « déshydratases ».
La réaction d'hydratation diffère de la réaction d'hydrolyse du fait que l'hydrolyse décompose la molécule en deux parties distinctes. La réaction inverse est la déshydratation.
Hydratation des alcènes[modifier | modifier le code]
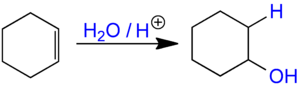
Les alcènes peuvent être hydratés en présence d'eau et d'un catalyseur acide pour donner un alcool[1], comme dans cet exemple de l'hydratation du cyclohexène en cyclohexanol :
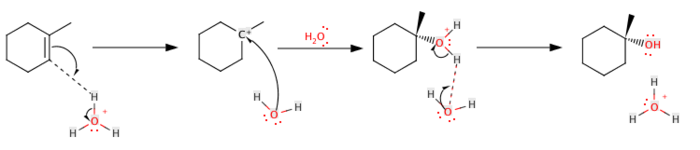
Cette réaction se déroule en deux étapes. Dans la première, l'alcène se protonise sur le carbone le moins substitué, formant ainsi un carbocation sur le carbone le plus substitué, suivant la règle de Markovnikov[2]. Dans un second temps, une molécule d'eau se lie au carbocation et est déprotonée par une autre molécule d'eau.
Hydratation des composés carbonylés[modifier | modifier le code]
Pour la plupart des composés carbonylés, la constante d'équilibre de la réaction d'addition de l'eau sur le carbonyle est défavorable[3]. Néanmoins, les aldéhydes peu encombrés peuvent être plus ou moins hydratés, le formaldéhyde étant pratiquement complètement hydraté en solution aqueuse (K = 2,28 × 103 dans l'eau à 25 °C[4]). Les cétones sont beaucoup moins hydratées que les aldéhydes, mais lorsque des groupements électronégatifs sont liés au carbone de la fonction carbonyle, la constante d'équilibre est favorable à l'hydratation, comme démontré dans le cas du chloral avec une constante d'équilibre en faveur de l'hydrate de chloral (K = 2,9 × 104 dans l'eau à 25 °C[4] :
Notes et références[modifier | modifier le code]
- (en) M. B. Smith et J. March, March's advanced organic chemistry : reactions, mechanisms, and structure, Hoboken (N.J.), John Wiley & Sons, , 6e éd., 2384 p. (ISBN 978-0-471-72091-1 et 9780470084960, présentation en ligne), chap. 15 (« Addition to Carbon–Carbon Multiple Bonds »), p. 1032-1035.
- (en) F. A. Carey et R. J. Sundberg, Advanced organic chemistry : Part A: Structure and mechanisms, New York, NY, USA, Springer, , 5e éd., 1199 p. (ISBN 978-0-387-44897-8 et 9780387448992, présentation en ligne), chap. 5 (« Polar Addition and Elimination Reactions »), p. 482-485.
- (en) F. A. Carey et R. J. Sundberg, Advanced organic chemistry : Part A: Structure and mechanisms, New York, NY, USA, Springer, , 5e éd., 1199 p. (ISBN 978-0-387-44897-8 et 9780387448992, présentation en ligne), chap. 7 (« Addition, Condensation and Substitution Reactions of Carbonyl Compounds »), p. 638-645.
- (en) J. P. Guthrie, « Carbonyl Addition Reactions: Factors Affecting the Hydrate–Hemiacetal and Hemiacetal–Acetal Equilibrium Constants », Can. J. Chem., vol. 53, no 6, , p. 898-906 (ISSN 0008-4042, DOI 10.1139/v75-125, lire en ligne).
Annexes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- (en) F. A. Carey et R. J. Sundberg, Advanced organic chemistry : Part A: Structure and mechanisms, New York, NY, USA, Springer, , 5e éd., 1199 p. (ISBN 978-0-387-44897-8 et 9780387448992, présentation en ligne).
- (en) M. B. Smith et J. March, March's advanced organic chemistry : reactions, mechanisms, and structure, Hoboken (N.J.), John Wiley & Sons, , 6e éd., 2384 p. (ISBN 978-0-471-72091-1 et 9780470084960, présentation en ligne).
Articles connexes[modifier | modifier le code]